
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Т 4 Л 9 ФОСФОР. Азот (Is22s22р3) типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду. Как и у других р-элементов 2-го периода, у
|
|
|
|
Азот
Азот (Is22s22р3) типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду. Как и у других р -элементов 2-го периода, у азота четыре валентные орбитали могут находиться в состоянии sр 3, sр 2 или sр -гибридизации. При двух последних гибридных состояниях возможно образование соответственно одной и двух p-связей. Степени окисления азота в соединениях –3, —1, +1, +3, +5, а также +2 и +4.
Природный азот состоит из двух устойчивых изотопов: 14N (99,635 %) и 15N (0,365 %), Содержание азота на Земле составляет 0,03 мол, доли, % Основная масса его входит в состав атмосферы (78, об. долей, %) в виде простого вещества. Из минералов промышленное значение имеют чилийская NаNО3 и индийская КNО3 селитры. Азот входит в состав белковых тел всех растительных и животных организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне и др.
 Простое вещество. Электронная конфигурация молекулы азота N2,
Простое вещество. Электронная конфигурация молекулы азота N2,
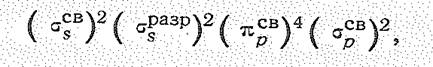
Рис. 1 Схема молекулярных орбиталей молекулы N2.
 что отвёчает тройной связи между атомами азота: NºN (d NN = 0,1095 нм). Вследствие этого молекула N2 исключительно прочна.
что отвёчает тройной связи между атомами азота: NºN (d NN = 0,1095 нм). Вследствие этого молекула N2 исключительно прочна.
Даже при 3000 оС степень диссоциации молекулярного азота на атомы достигает всего лишь 0,1%.
Вследствие прочности молекулы N2 многие соединения азота эндотермичны. Кроме того, энтропия их образования отрицательна (N2 - газ). Отсюда молекулярный азот химически малоактивен, а соединения азота термически малоустойчивы и относительно легко разлагаются при нагревании. Поэтому азот на Земле находится главным образом в свободном состоянии.
Молекула N2 слабо поляризуется. Силы взаимодействия между молекулами N2 очень слабые и не могут препятствовать беспорядочному движению молекул (энтальпийный фактор проявляется значительно слабее, чем энтропийный). Поэтому в обычных условиях молекулярный азот — газ. Температуры плавления азота (—210,0 °С), а кипения (—195,8°С) очень низкие; он плохо растворяется в воде и других растворителях.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При активации молекул N2 (нагреванием, действием электроразряда или ионизирующих излучений) азот обычно выступает как окислитель и лишь при взаимодействии с фтором и кислородом — как восстановитель.
В промышлённости азот получают фракционированной перегонкой жидкого воздуха, в лаборатории — термическим разложением соединений, чаще всего NH4NO2;
N-3H4N+3O2 = N20 + 2H2O
Основная масса получаемого азота используется для синтеза аммиака; азот применяют также для создания инертной атмосферы в химических и других производствах.
Соединения со степенью окисления азота —3. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды:
3Mg + N2 = Mg3N2; 2B + N2 = 2BN; 2H2 + N2 = 2H3N
Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным:
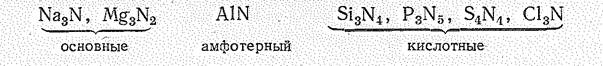
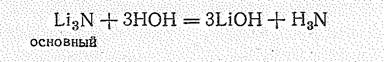 Нитриды s -элементов I и II групп, например Li3N и Мg3N2 — кристаллические вещества. При температуре выше 300 oС разлагаются. Нитриды этого типа химически довольно активны. Они, например, легко разлагаются водой, образуя щелочь и аммиак:
Нитриды s -элементов I и II групп, например Li3N и Мg3N2 — кристаллические вещества. При температуре выше 300 oС разлагаются. Нитриды этого типа химически довольно активны. Они, например, легко разлагаются водой, образуя щелочь и аммиак:
Нитриды галогенов — эндотермические соединения, В свободном состоянии выделен лишь жидкий С13N (DНfo = 229 кДж/моль) легко разлагающийся со взрывом. По химической природе это кислотное соединение:
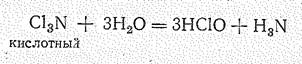
Нитриды BN, AlN и Si3N4, Gе3N4 — твердые полимерные вещества с высокими температурами плавления (2000—3000 °С); они либо диэлектрики, либо полупроводники.
Весьма разнообразны нитриды d -элементов, Это кристаллические вещества переменного состава. Чаще всего встречаются нитриды типа МN (ТiN, VN, СrN), М2N(NbN, Сr2N, Мо2N). Они проявляют металлические свойства: имеют металлический блеск и электронную проводимость. Нитриды этого типа отличаются высокой твердостью и тугоплавкостью часто превышающей тугоплавкость исходного металла:
 Большинство из нитридов d -элементов химически очень стойки: не разрушаются водой, растворами кислот, расплавлёнными металлами, устойчивы против окисления на воздухе. Перечисленные особенности позволяют использовать нитриды в качестве высокопрочных материалов.
Большинство из нитридов d -элементов химически очень стойки: не разрушаются водой, растворами кислот, расплавлёнными металлами, устойчивы против окисления на воздухе. Перечисленные особенности позволяют использовать нитриды в качестве высокопрочных материалов.
Получены также бинарные нитриды d -элементов, по составу отвечающие обычным степеням окисления элементов, например Zr3N4, Та3N5.
Взаимодействие основного и кислотного нитридов приводит к образованию смешанных нитридов, например Li3АlN2, Li5GеN3 Li5ТiN3, Li9WN5:
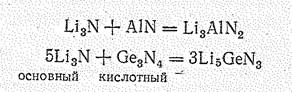
Из ковалентных нитридов наибольшее практическое значение имеет нитрид водорода Н3N — аммиак. В обычных условиях это бесцветный газ с резким удушающим запахом. Молекула Н3N имеет форму тригональной пирамиды (d NH = 0,1015 нм, ÐНРН = 107,3 °). Согласно теории валентных связей атом азота в молекуле Н3N находится в состоянии sр 3-гибридизации, Из четырех sр 3-гибридных орбиталей азота три участвуют в образовании трех s-связей N— Н, а четвертую орбиталь занимает несвязывающая электронная пара. В терминах орбиталей теории молекулярных орбиталей это соответствует заполнению трех связывающих и одной почти несвязывающей молекулярной s-орбитали:
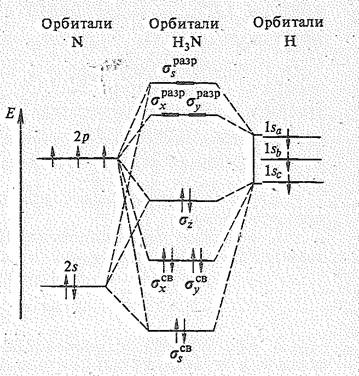
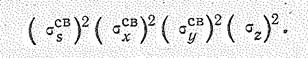
На рис. 2 приведена энергетическая диаграмма орбиталей молекулы аммиака.
Из семи исходных атомных орбиталей (2 s -, 2 p х, 2 p у и 2 р z-орбиталей азота и 1 s -орбиталей трех атомов водорода) возникает семь молекулярных орбиталей: три sсв, три sразр. и одна несвязываюцая sz.
В соответствии с характером распределения электронов по орбиталям молекула Н3N имеет три первых потенциала ионизации (22,4; 15,2 и 10,5 эВ), что отвечает удалению электрона с одного из трех заполненных энергетических уровней.
Вследствие sр 3-гибридизации валентных орбиталей атома азота не-связывающее двухэлектронное облако отчетливо ориентировано в пространстве. Поэтому молекула Н3N — резко выраженный донор электронной пары и обладает высокой полярностью (m = 0,49×10-29 Кл×м).
Полярность связи N – Н обусловливает между молекулами Н3N водородную связь. Поэтому температуры плавления (—77,75 °С) и кипения (—33,42 °С) аммиака довольно высоки, он характеризуется значительной энтальпией испарения и легко сжижается. На этом основано его применение в холодильных машинах. Жидкий аммиак хранят в стальных баллонах.
Среди водородных соединений р -элементов V группы аммиак занимает такое же особое положение, как вода среди водородных соединений р -элементов VI группы и как фторид водорода среди галогеноводородов.
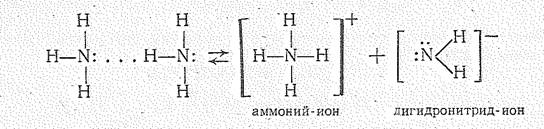
Собственная ионизация аммиака ничтожно мала, и ионное произведение аммиака [NН4+][NН2-] составляет всего лишь 2×10-33 (при —50 °С).
Жидкий аммиак, как и вода, сильный ионизирующиЙ растворитель. При этом производные NН4+ в жидком аммиаке (подобно производным ОН3+ в воде) ведут Себя как кислоты – аммонокислоты), а производные NН2- (подобно производным ОН- в воде) — как основания (аммонооснования). Например, сильными кислотами в жидком аммиаке являются NН4Сl, NН4NO3, а основаниями КNН2 Ва(NН2)2. Дигидронитриды Zn(NН2)2, А1(NН2)3 ведут Себя как амфотерные соединения. Производные NН2- называются также амидами, а производные NН2- — имидами,
Жидкий аммиак как растворитель широко применяется для проведения различных синтезов.
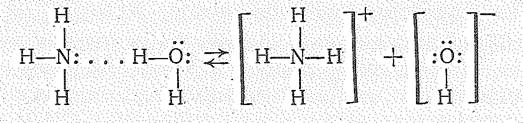 Аммиак очень хорошо растворяется в воде (при 20 °С в одном объеме Н2О растворяется около 700 объемов Н3N). Хорошая растворимость объясняется образованием водородной связи между молекулами Н3N и Н2О. Поскольку молекула Н3N — лучший акцептор протона, чем Н2О, то в растворе имеет место ионизация:
Аммиак очень хорошо растворяется в воде (при 20 °С в одном объеме Н2О растворяется около 700 объемов Н3N). Хорошая растворимость объясняется образованием водородной связи между молекулами Н3N и Н2О. Поскольку молекула Н3N — лучший акцептор протона, чем Н2О, то в растворе имеет место ионизация:
Появление ионов ОН- создает щелочную среду раствора. Но, как это видно из значения константы ионизации
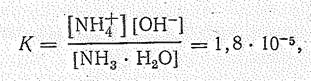
реакция протекает в незначительной степени. В 1 М растворе ионизируется, например, всего лишь 0,4% молекул Н3N и Н2О.
При взаимодействии ионов NН4+ и ОН- вновь образуются молекулы Н3N и Н2O, между которыми имеет место водородная связь. Следовательно, ионное соединение NН4ОН (гидроксид аммония) не существует, как не существуют гидроксид оксония ОН3ОН и дигидронитрид аммония NН4NН2.
Ионы NН4+ значительно легче образуются при взаимодействии аммиака с кислотами, например:
Н3N + НСlO4 = NН4СlО4
При этом чем сильнее кислоты, тем устойчивее их аммонийые производные. Например, в ряду NН4F — NН4Сl — NН4Вr — NН4I термическая устойчивость солей возрастает.
Вследствие близости размеров ионов NН4+ (r NH4+ = 0,143 нм) и K+ (r K+ =
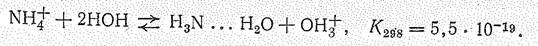 = 0,133 нм) соли аммония по свойствам сходны с солями калия. Так, почти все соли аммония хорошо растворимы и полностью диссоциируют в воде. Их отличие проявляется при гидролизе, поскольку ионы NН4+ и OН- связываются в гидрат аммиака и возникает кислая среда:
= 0,133 нм) соли аммония по свойствам сходны с солями калия. Так, почти все соли аммония хорошо растворимы и полностью диссоциируют в воде. Их отличие проявляется при гидролизе, поскольку ионы NН4+ и OН- связываются в гидрат аммиака и возникает кислая среда:
При нагревании аммиак проявляет восстановительные свойства, окисляясъ обычно до свободного азота:
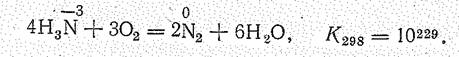
Эта реакция практически необратима (DН < 0). На восстановительной способности Н3N основано применение NН4Сl (нашатыря) для очистки от оксидов поверхности металлов при пайке.
В промышленности аммиак получают синтезом из простых веществ:
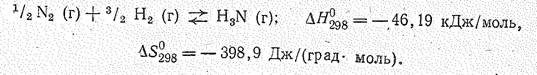
Поскольку энтальпия образования аммиака невелика, а его синтез сопровождается уменьшением энтропии в соответствии с принципом Ле Шателье, процесс проводят при высоком давлении (107— 108 Па), для ускорения реакции применяют катализатор. В качества катализатора наибольшую активность проявляют простые вещества элементов подгруппы железа. В технике обычно применяют железный катализатор (с добавлением активаторов). Процесс ведут при 400—500 °С.
Аммиак выделяется также при коксовании каменного угля. В лаборатории его получают действием щелочей на аммонийные соли. Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака и его водных растворов, NН4NО3, (NН4)2SО4 и др. Водный раствор аммиака (аммиачная вода) — важный реактив для проведения различных реакций.
Соединения со степенью окисления азота —2. Азот, как и кислород, образует соединения перекисного типа — пернитриды. Последние можно рассматривать как производные радикалов, образующихся при последовательном разрыве связей в молекуле N2:
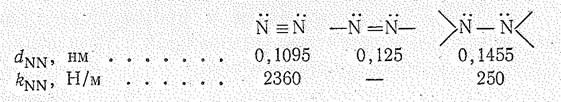
Простейшим представителем пернитридов водорода Н4N2, называемый гидразином или диамидом. Молекула гидразина полярна (m = 0,62×10-29 Кл×м), ее структура может быть представлена схемой
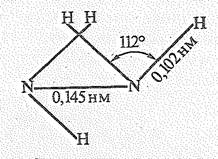
Гидразин бесцветная жидкость (т. пл. 2 °С, т. кип. 113,5 °С), молекулы которой соединены водородной связью. Собственная ионизация жидкого гидразина незначительна.
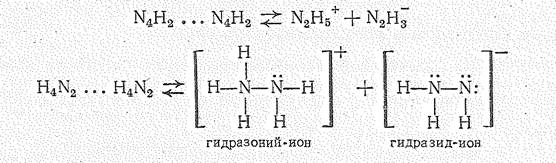
Ионное произведение [N2H5+][N2H3-] = 2×10-25 (при -33,4 °С).
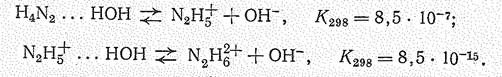 Гидразин — хороший ионизирующий растворитель. С водой и спиртом он смешивается в любых соотношениях. Водные растворы его показывают щелочную среду:
Гидразин — хороший ионизирующий растворитель. С водой и спиртом он смешивается в любых соотношениях. Водные растворы его показывают щелочную среду:
Являясь донором двух электронных пар, гидразин с кислотами образует два ряда гидразоний - производных, представляющих собой соли, например [N2Н5]Сl, [N2Н6]Сl2, [N2Н6]SO4.
Растворы гидразина получают осторожным окислением аммиака гипохлоритом:
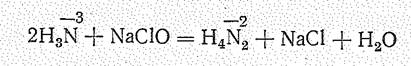
Гидразин — эндотермическое соединение (DНo = +55,5 кДж/моль, DGo = +149,2 кдж/моль). Гидразин и производные гидразонийионов значительно менее устойчивы, чем аммиак и производные аммония. Гидразин - сильный восстановитель:
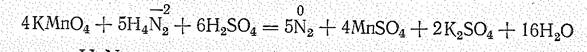
На воздухе Н4N2 может гореть с большим выделением теплоты:
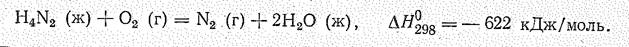 Пернитрид водорода состава Н2N2 (диимид) очень неустойчив, но известны многочисленные органические производные,
Пернитрид водорода состава Н2N2 (диимид) очень неустойчив, но известны многочисленные органические производные,
Соединения со степенью окисления азота —1. Промежуточное положение между пероксидом и пернитридом водорода по составу и структуре занимает гидроксиламин:
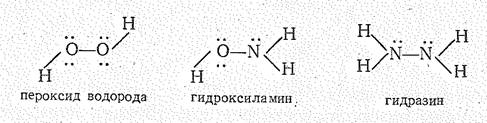
Это — белое кристаллическое вещество (Т. пл. 33 °С, DGo = —17,4 кДж/моль), образуется при восстановлении раствора НNO3 атомарным водородом в процессе электролиза:
НNO3 + 6Н = NH2OH + 2Н2O
Гидроксиламин — донор электронной пары; образует водородные связи. С водой NH2OH смешивается в любых отношениях, Подобно H3N и Н4N2, в воде NН2ОН — слабое основание (К = 2×10-8):
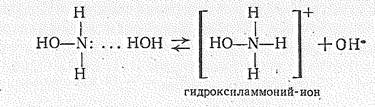
С кислотами дает соли гидроксиламмония [NН3ОН]+, например [NН3OН]С1, [NН3ОН]NO3, [NН3OН]2SO4
NН2ОН + НСl = [NН3OН]Cl
Соли гидроксиламмония устойчивые бесцветные кристаллические вещества, растворимые в воде.
В ряду Н2О2 — NН2OН — Н4N2 окислительная активность падает, а восстановительная возрастает. Так, если для Н2O2 наиболее характерны окислительные свойства, а для Н4N2 — восстановительные, то NН2OН в щелочной среде является сильным восстановителем, а в кислой среде отчетливо проявляет окислительные свойства:
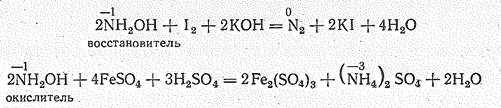
Как и пероксид водорода, NН2OН легко разлагается (в особенности при нагревании) по механизму диспропорционировавия:
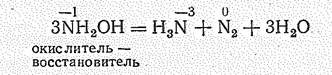
Гидроксиламин и соли гидроксиламмония применяются главным образом в органическом синтезе.
Будучи донорами электронных пар, NН2OН и Н4N2, как и H3N могут входить в качестве лигандов в комплексные соединения. Напрямер: [Со(NН3)6] Сl3, [Со (NН2OН)6 ]Сl3, [Со(N2Н4)б]Сl3.
Соединения азота (III). Для азота в степени окисления +3 известны фторид NF3, оксид N2O3, оксогалиды NОНаl, фторохлорид NF2Сl, а также производные аниона NO2-.
О к с и д азота (III) N2О3 существует только в твердом состоянии при низких температурах, В виде жидкости и пара в значительной степени диссоциирован:
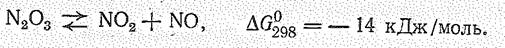
Его получают охлаждением смеси NO2 и NО. Согласно данным, полученным с помощью инфракрасной спектроскопии, полагают, что кристаллы N2О3 состоят из стабильной модификации ОNNO2 и нестабильной ОNОNО:

Жидкий N2O3 интенсивносинего цвета, (при —100 °С), образуя кристаллы светло-синей окраски.
Оксид азота (III) — кислотный оксид, легко поглощается щелочами, образуя нитриты:
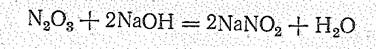
Диоксонитрат (III) водорода НNO2 известен лишь в водном растворе, который является кислотой (К = 4×10-4), называемой а зотистой. Для НNО2 вероятны две таутомерные структуры:
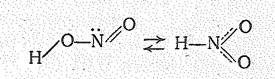
Диоксонитрат (III), или нитрит-ион NО2-, имеет угловую форму;
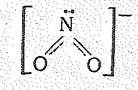
Нитриты (III) металлических элементов достаточно устойчивы, а нитриты щелочных металлов даже возгоняются без разложения. Последние получаются при растворении в щелочах.
Производные азота (III) проявляют и восстановительные, и окислительные свойства:
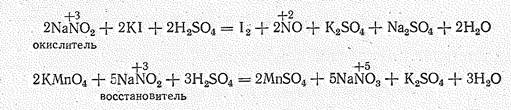
Кроме того, они склонны к реакциям диспропорпионирования:
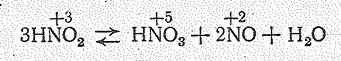
Молекулы оксогалогенидов азота (III) ( галогениды нитрозила) имеют угловую форму:
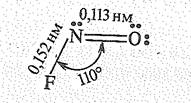
В обычных условиях это относительно малостойкие газообразные вещества. В ряду NОF —NOCl — NОВr устойчивость соединений падает, а NOI получить не удалось. По химической природе фториды, оксогалиды, как и оксид азота (III), кислотные соединения, о чем свидетельствует, например, их отношение к воде:
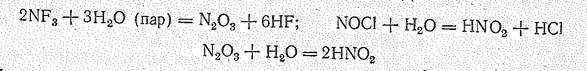
Нитрозилхлорид NOCl, например, желтобурый газ, растворимый во многих органических растворителях, с водой образует HNO2 и HCl. Получается взаимодействием NO2 или HNO3 с HCl (в присутствии катализатора – MnO2).
Соединения азота (V). Степень окисления +5 азот проявляет в оксиде N2О5, оксонитриде NON, диоксофториде NО2F, а также в триоксонитрат (V)-ионе NO3- и динитридонитрат (V)-ионе NN2-. Все эти соединения можно рассматривать как производные четырехвалентного нона N+:

Оксид азота (V) N2O5 — белое кристаллическое вещество (т. возг. 33°С), образованное нонами NО2+ и NО3-. В газовой фазе молекула N2O5, по-видимому, имеет структуру
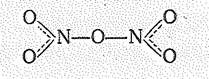
Его получают осторожным обезвоживанием НNО3 (например, с помощью Р2О5) или окислением NO2 озоном. В обычных условиях N2О5 (DG = +114,1 кДж/моль) постепенно разлагается на NO2 и O2, при нагревании взрывается.
Оксонитрид азота (V) NОN (закись азота N2О, «веселящий газ») получается разложением аммиачной селитры (при 250 °С):
NН4NО3 = N2О + 2Н2О
Это бесцветный газ (т.пл. —91,0 °С, т.кип. —88,5 °С) со слабым приятным запахом. В соответствии с sр -гибридизацией валентных орбиталей молекула имеет линейное строение (m = 0,05×10-29 Кл×м, d NN = 0,113 Нм, d NO = 0,118 пм), которое может быть передано наложением валентных схем:

это соответствует электронной конфигурации:
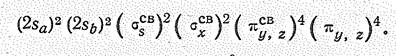
Уже при слабом нагревании N2О (DGo = + 104,1 кДж/моль) распадается, выделяя кислород. Поэтому в нем могут гореть углеродистые вещества, а его смеси с водородом и аммиаком взрывают, Оксонитрид азота (V) растворяется в воде, но устойчивых соединений не образует.
 Триоксонитрат (V)-ион NО3- имеет форму плоского треугольника (ÐОNО = 120 °, d NO = 0,122 нм), что обусловлено sр 2- гибридизацией валентных орбиталей атома азота:
Триоксонитрат (V)-ион NО3- имеет форму плоского треугольника (ÐОNО = 120 °, d NO = 0,122 нм), что обусловлено sр 2- гибридизацией валентных орбиталей атома азота:
Молекула триоксонитрата (V) водорода НNО3 имеет строение:
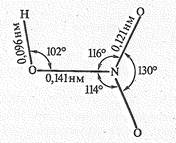
При обычных условиях НNО3 бесцветная жидкость (пл. 1,52 г/см3), кипящая при 84,1 °С, а при —41,6 °С затвердевающая в прозрачную кристаллическую массу.
Собственная ионизация жидкого НNО3 незначительна. С водой НNO3 смешивается в любых отношениях. Его растворы — сильная кислота, называемая азотной. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство НNO3 осуществляется по стадиям: окисление Н3N в NО кислородом воздуха на платиновом катализаторе:
4H3N + 5O2 = 4NO + 6H2O K298 = 10163
окисление NО в NO2:
2NO + O2 = 2NO2
и взаимодействие последнего с водой:
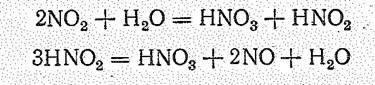
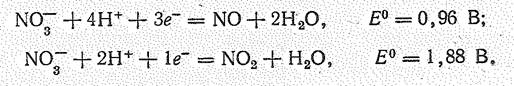 Азотная кислота обладает сильно выраженными окислительными свойствами:
Азотная кислота обладает сильно выраженными окислительными свойствами:
Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. Образование тех или иных продуктов взаимодействия зависит от концентрации НNО3, активности простого вещества и температуры. Достаточно разбавленная кислота в основном восстанавливается до NН4NO3 с повышением ее концентрации становится более характерным образование NO; концентрированная НNО3 восстанавливается до NO2.
Смесь одного объема НNО3 и трех объемов НСl называют царской водкой. Она растворяет платину, золото и другие неактивные металлы, переводя их в комплексные хлориды. Нитрат-ион NО3- в нейтральной среде окислительные свойства практически не проявляет
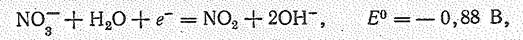
но является хорошим окислителем при сплавлении:
Триоксонитрат (V) водорода при нагревании и освещении легко разлагается: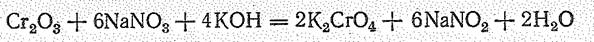
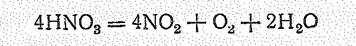
Нитраты большинства других элементов устойчивы. Нитраты металлов растворимы в воде. Нитраты имеют большое значение как удобрения (особенно калийная и аммонийная селитры). Азотная кислота применяется для получения минеральных удобрений, взрывчатых веществ, органических красителей, пластических масс и в других многочисленных производствах.
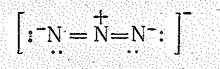 Динитридонитрат (V)-ион, или азид -ион, NN2- (N3-) в соответствии с sр -гибридизацией валентных орбиталей N+ имеет линейную форму (d NN = 0,115 нм):
Динитридонитрат (V)-ион, или азид -ион, NN2- (N3-) в соответствии с sр -гибридизацией валентных орбиталей N+ имеет линейную форму (d NN = 0,115 нм):
Распределение валентных электронов по молекулярным орбиталям отвечает электронной конфигурации:
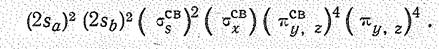
Структура молекулы динитридонитрата (V) водорода НNN2 (НN3) приведена ниже:
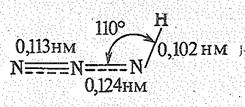
В обычных условиях НNN2 — бесцветная летучая жидкость (т. пл. —80 оС, т. кип, 37 °С) с резким запахом. При ударе или нагревании НNN2 и ряд других азидов распадаются со взрывом. На этом основано применение азида свинца Рb(N3)2 в качестве детонатора. Относительно устойчивы ионные азиды, которые при нагревании (до 300 °С) разлагаются без взрыва:
2NaNN2(т) = 2Nа (ж) + 3N2 (г)
Эта реакция используется для получения особо чистого азота. Водный раствор НNN2 — азотистоводородная кислота (К = 2,6×10-5), по силе близкая к уксусной. В разбавленных растворах НNN2 практически устойчива. Ее получают взаимодействием гидразина и азотистой кислоты:
Н4N2 + НNО2 = НNN2 + 2Н2O
Исходным продуктом для получения других азидов является NаNN2, который получают действием NО2 на NаNН2 при 200 °С:
NаNН2 + О = N+=N- ® NаNN2 + Н2O
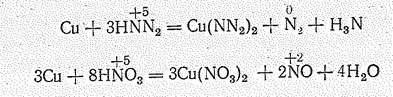 Ион NN2- окислитель. По окислительным свойствам НNN2 напоминает НNО3. Так, если, при взаимодействии с металлами НNО3 дает оксид азота (II) и воду, то НNN2 образует N2 («нитрид азота») и Н3N:
Ион NN2- окислитель. По окислительным свойствам НNN2 напоминает НNО3. Так, если, при взаимодействии с металлами НNО3 дает оксид азота (II) и воду, то НNN2 образует N2 («нитрид азота») и Н3N:
Смесь НN3 и НСl ведет себя подобно царской водке.
Соединения азота (I), азота (II) и азота (IV). Для азота, как и для хлора, характерны достаточно устойчивые оксиды с нечетным числом электронов NO и NО2. Их можно рассматривать как устойчивые свободные радикалы. Оба оксида — эндотермические соединения — их стандартные энтальпии DНo и энергии Гиббса. образования DGo имеют положительное значение.
В обычных условиях оксид азота (II) NО бесцветный газ (т. пл.—163,7 °С, т. кип. —151,7 °С). В лаборатории его получают действием разбавленной НNО3 на медь, а в промышленности окислением Н3N на платиновом катализаторе. В отличие от всех остальных оксидов азота NО образуется также прямым взаимодействием простых веществ:
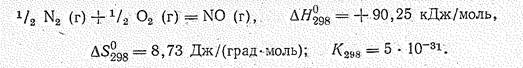
Синтез NО из простых веществ сопровождается возрастанием энтропии системы. Поэтому в соответствии с уравнением
DG = DH — TDS
при соответствующей температуре DG может стать отрицательной величиной. При этих условиях начинает доминировать энтропийный фактор. Поскольку DS процесса очень незначительно, то отрицательное значение DGт достигается при высоких температурах (порядка 3000 °С).
Для всех же остальных оксидов азота DG при всех температурах — величина положительная, так как DS процесса образования их из простых веществ имеет отрицательное значение. Поэтому прямой синтез других оксидов невозможен.
Молекула NО парамагнитна. Согласно теории молекулярных орбиталей в NО один из электронов находится на ppразр-орбитали:
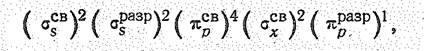
т. е. порядок связи в 1О составляет 2,5, Структурную формулу NО можно изобразить следующим образом[1]:
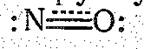 Тремя точками обозначена связь, образованная за счет пары связывающих и одного разрыхляющего электронов, что соответствует порядку связи 0,5. (В сумме 2,5)
Тремя точками обозначена связь, образованная за счет пары связывающих и одного разрыхляющего электронов, что соответствует порядку связи 0,5. (В сумме 2,5)
Вследствие повышенной кратности связи молекула NO достаточно устойчива, и ее распад становится заметным лишь при 500°С. Оксид азота (П) химически активное соединение, легко восстанавливается (при действии SO2, Сr2+) в растворах до NН2ОН и Н3N; с водородом образует гремучую смесь. Легко окисляется кислородом, галогенами и др.:
В молекуле NO непарный электрон находится на энергетически невыгодной молекулярной pразр-орбитали, поэтому не может образовать устойчивой связи, Этим объясняется несклонность NО димеризоваться в N2O2. Только при понижении температуры NО димеризуется, и твердый оксид азота (II) (синего цвета) состоит из неустойчивых диамагнитных молекул N2O2.
Но оксид азота (II) легко реагирует с другими свободными радикалами. Поэтому он является ингибитором цепных реакций. Если реакция протекает по радикально-цепному механизму, то добавление NО приводит к обрыву цепей и резкому замедлению реакции.
Молекула NO может терять непарный электрон с pразр-орбитали, образуя нитрозил (нитрозоний)-ион NO+:

Ион NO+ изоэлектронен молекуле N2. В отличие от NO ион NO+ диамагнитен. Его строение соответствует электронной конфигурации
Производными иона являются, например, [NO]ClO4, [NO2]SеО4. Это солеподобные вещества с температурой плавления порядка 70—200 °С. Водой легко разрушаются. Их можно получить взаимодействием N2О3 с концентрированными кислотами, например:
N2О3 + Н2SеО4 = (NО)2SеO4 + Н2O
При взаимодействии с наиболее активными металлами в жидком аммиаке NO сам выступает как окислитель:
Производные о неустойчивы и изучены недостаточно.
Молекула NО выступает как лиганд в разнообразных комплексах, называемых нитрозильными. По своему характеру молекула NO относится к лигандам s- и p-донорного и p-акцепторного типа.
Диоксид азота NО2 газ бурого цвета (т. пл. – 11,2 °С, т. кип, 21 °С), токсичен. Его молекула парамагнитна имеет угловую форму:

Длина связи d NO(0,120 нм) имеет промежуточное значение между длиной одинарной (0,143 нм) и двойной (0,118 нм) связи. Это отвечает порядку связи 1,5.
Молекулы NО2 даже в парах частично димеризованы:
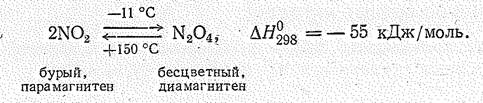
Жидкий и твердый диоксид азота бесцветен, состоит из плоских молекул N2O4:
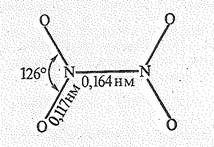
На примере молекулы NO2 рассмотрим более подробно строение трехатомных молекул угловой формы с p-связями. В образовании молекулы NO2 принимают участие 2 s -, 2 p x, 2 p y и 2 р z-орбитали атома азота, 2 р x-, 2 р y,- и 2 р z-орбитали двух атомов кислорода. Из десяти атомных орбиталей образуются десять молекулярных орбиталей. Поскольку молекула NO2, как и Н2O, имеет угловую форму, то s-орбитали NO2 аналогичны s-орбиталям молекулы H2O. Это пять молекулярных орбиталей: ssсв и ss(z)разр, sxсв и sxразр а также sz. В отличие от Н2O в молекуле NO2 за счет 2 р y-орбиталей азота и 2 р y-орбиталей двух атомов кислорода образуются трехцентровые молекулярные pyсв- и pyразр-орбитали. Кроме того, три орбитали атомов кислорода играют роль несвязывающих молекулярных орбиталей, которые обозначим py, 2 р xa и 2 p хб. Энергетическая диаграмма орбиталей молекулы NO2 показана на рис. 3.
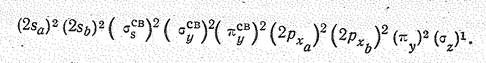 Семнадцать валентных электронов молекулы NO2 образуют следующую конфигурацию:
Семнадцать валентных электронов молекулы NO2 образуют следующую конфигурацию:
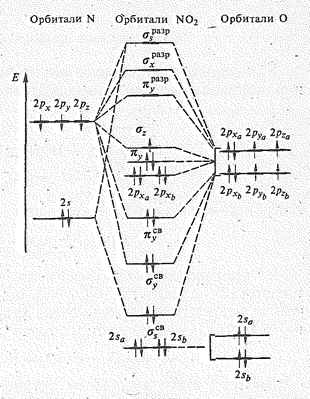
| Рис. 3. МО молекулы NO2.
 Общее число связывающих электронов равно шести – Общее число связывающих электронов равно шести –
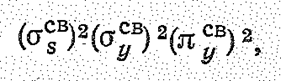
|
что соответствует среднему порядку связи 1,5. Остальные электроны играют роль несвязывающих. В терминах теории валентных связей атому азота в NО2. можно приписать sр 2-гибридизацию валентных орбиталей (которая возникает за счет 2 s -, 2 р x-, 2 р y-орбиталей). Одну из sр 2-гибридных орбиталей (sz-орбиталь) занимает непарный электрон, две другие sр 2-орбитали участвуют в образовании двух s-связей N—O (двух молекулярных ssсв- и sxсв-орбиталей). Кроме того, 2 р y-орбиталь азота и 2 р y-орбиталь двух атомов кислорода участвуют в образовании делокализованной p-связи (молекулярная pyсв-орбиталь). Таким же образом объясняется строение молекул Сl2О, О3, SO2, ОF2, СlО2, NО2- и др.
Молекула NО2 может терять (энергия ионизации 9,78 эВ) и приобретать электроны (сродство к электрону 1,62 эВ): (см. №1)
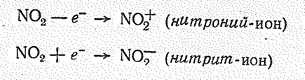 №1 №1
| №2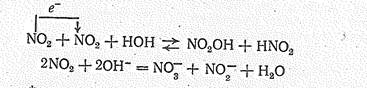
|
Указанные превращения определяют способность к диспропорционированию при взаимодействии с водой и растворами щелочей: (см.№2).
Нитроний-ион NO2+ образуется при самоионизации жидкого HNO3:
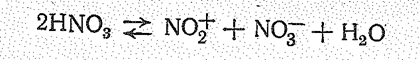
Из производных нитроний -иона NО2+ следует указать [NO2]СlО4, твердый оксид азота (V) [NО2]NO3 и др. Соли нитрония – кристаллические вещества, химически очень активны, быстро гидролизуются влагой воздуха. Соли нитрония можно получить, например, по реакции
Nа2O5 + НСlО4 = NOClO4 + HNO3
Диоксид азота химически активен; в его атмосфере горят уголь, сера, фосфор. В лаборатории NO2 получают взаимодействием меди с концентрированной азотной кислотой:
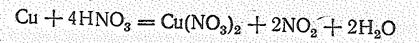
И термическим разложением ряда оксонитратов (V), например:

Диоксид азота применяется как нитрирующий агент, в частности для получения безводных нитратов.
[1] Тремя точками обозначена связь, образованная за счет пары связывающих и одного разрыхляющего электронов, что соответствует порядку связи 0,5,
Фосфор Р (1 s 22 s 22 р 63 s 23 р 3) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота — элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. Максимальное координационное число фосфора шесть. Как и для других элементов 3-го периода, р p — р p-связывание для атома фосфора не характерно и поэтому в отличие от азота sр - и sр 2-гибридные состояния орбиталей фосфора неустойчивы. Фосфор в соединениях проявляет степени окисления от —3 до +5. Наиболее характерна степень окисления +5.
Согласно другой точке зрения различие свойств фосфора и азота объясняется наличием в атоме фосфора валентных 3 d -орбиталей.
Для фосфора наиболее прочны связи с фтором и кислородом.
В земной коре в соответствии с его устойчивой степенью окисления фосфор содержится в основном в виде фосфатов (V). Наиболее распространены минералы фосфорит Са3(РО4)2, гидроксоапатит Са5(РО4)3(ОН), фторапатит Са5(РО4)3F. Фосфор Входит в состав живых организмов. Гидроксоапатит составляет минеральную часть костей, фторапатит — зубов, а сложные органические производные фосфора входят в состав клеток мозга и нервов.
Общее содержание фосфора в земной коре 0,05 мол. доли, %. Он имеет только один природный изотоп 31Р. Получены его искусственные радиоактивные изотопы.
Простые вещества. Атомы фосфора объединяются в двухатомные Р2, четырехатомные Р4 и полимерные Р2∞ молекулы. Молекулы Р2 (d PP = 0,19 нм), построенные аналогично N2, существуют лишь при температурах выше 1000°С.
В жидком и растворенном состоянии, а также в парах при температурах ниже 1000°С устойчивы четырехатомные молекулы Р4, имеющие форму тетраэдра. При конденсации паров образуется белый фосфор (пл. 1,8 г/см3). Он имеет молекулярную кристаллическую решетку, в узлах которой находятся молекулы Р4. Белый фосфор — мягкое бесцветное воскообразное вещество. Он легкоплавок (Тпл. 44,1 °С, Ткип. 275 °С), летуч, растворяется в сероуглероде и в ряде органических растворителей. Белый фосфор чрезвычайно ядовит.
В молекуле Р4 связи Р—Р (d PP = 0,221 нм, ЕР–Р = 200 кДж/моль) довольно легко разрываются. Этим объясняется высокая химическая активность белого фосфора и склонность переходить при хранении (в особенности при нагревании) в более стабильные полимерные модификации, например:

При нормальных условиях наиболее устойчив черный фосфор, но вследствие высокой энергии активации переход других модификаций в черный фосфор при обычных условиях не происходит. Его можно получить из белого при. 
 200 °С и 1,2×1010 Па:
200 °С и 1,2×1010 Па:
 Черный фосфор имеет атомно-слоистую решетку с характерным для фосфора пирамидальным расположением связей. (Расстояние между соседними атомами 0,218 нм, а между слоями 0,368 нм, ÐРРР = 99 °)..По внешнему виду черный фосфор (пл. 2,7 г/см3) похож на графит но является полупроводником (DЕ = 0,133 эВ).
Черный фосфор имеет атомно-слоистую решетку с характерным для фосфора пирамидальным расположением связей. (Расстояние между соседними атомами 0,218 нм, а между слоями 0,368 нм, ÐРРР = 99 °)..По внешнему виду черный фосфор (пл. 2,7 г/см3) похож на графит но является полупроводником (DЕ = 0,133 эВ).
Существует несколько форм красного фосфора. Их структуры окончательно не установлены. Известно, что они являются полимерными веществами, состоящими из пирамидально связанных атомов. В зависимости от способов получения красный фосфор обладает различными свойствами. Например, его плотность изменяется в интервале 2,0 ¸ 2,4 г/см3, температура плавления 585 ¸ 600 °С, цвет — от темно- коричневого до красного и фиолетового.
Для перевода красного фосфора в жидкое, а также растворенное состояние необходим разрыв связей в полимерных молекулах. Поэтому полимерные модификации имеют высокие температуры плавления, практически не растворяются ни в одном из растворителей. При возгонке красного фосфора (423 °С) в пар переходят молекулы Р2, которые затем рекомбинируются в молекулы Р4. Таким образом, при конденсации паров образуется белая, а не красная модификация.
Красный и особенно черный фосфор химически намного устойчивее белого. Так, если белый фосфор на воздухе самовоспламеняется при 50 °С, то красный — выше 250 °С, а черный — выше 400 °С. В отличие от белого высокополимерные модификации фосфора не ядовиты. Вследствие высокой химической активности белый фосфор хранят под водой и по возможности в темноте.
Фосфор проявляет восстановительные и окислительные свойства. Он легко окисляется кислородом, галогенами, серой и др. При недостатке окислителя обычно образуются соединения фосфора (III) (Р2О3, РНаl3, Р2S3), при избытке — соединения фосфора (V) (Р2O5, РНаl5, Р2S5). Окислительная активность фосфора проявляется при взаимодействии с металлами. При нагревании в воде и в особенности в щелочных растворах фосфор (белый) диспропорционирует.
8Р0 + 3Ва(ОН)2 + 6Н2О = 2Р-3Н3 + 3Ва(Н2Р+1О2)2
 В технике фосфор получают прокаливанием фосфата кальция с углем и песком в электропечах при 1500 °С:
В технике фосфор получают прокаливанием фосфата кальция с углем и песком в электропечах при 1500 °С:
Эта реакция эндотермична, но сопровождается увеличением энтропии. Температура, при которой она протекает, определяется условием ТDS>DH. При конденсации выделяющихся паров образуется белый фосфор, который длительным нагреванием при 280—340°С переводят в красный. Основная масса красного фосфора используется в спичечном производстве.
Соединения со степенью окисления фосфора —3. При нагревании фосфор окисляет почти все металлы, образуя фосфиды. В зависимости от природы металла доля того или иного типа связи в фосфидах меняется в широких пределах. Так, фосфиды s -элементов II группы состава Э3Р2 можно рассматривать как ионко-ковалентные соединения, Они солеподобны, легко разлагаются водой:

Фосфиды d -элементов (обычно типа МР, МР2, М3Р) имеют серый или черный цвет, металлический блеск и электропроводны. Фосфиды этого типа химически малоактивны.
 Ковалентным фосфидом является фосфид водорода Н3Р (фосфин). С водородом фосфор практически не взаимодействует. Фосфин (DGo = +13,4 кДж/моль) получают косвенным путем. Образуется Н3Р при гидролизе некоторых фосфидов, а также при диспропорционировании фосфора в щелочной среде при нагревании:
Ковалентным фосфидом является фосфид водорода Н3Р (фосфин). С водородом фосфор практически не взаимодействует. Фосфин (DGo = +13,4 кДж/моль) получают косвенным путем. Образуется Н3Р при гидролизе некоторых фосфидов, а также при диспропорционировании фосфора в щелочной среде при нагревании:
Молекула Н3Р, как и Н3N, имеет форму тригональной пирамиды, (d PN = 0,142 нм, ÐНРН = 93,5 °). Ее электрический момент диполя значительно меньше (0,18×10-29 Кл×м), чем у молекулы Н3N. Водородная связь между молекулами Н3Р практически не проявляется, поэтому фосфин характеризуется более низкими температурами плавления (—133,8 °С) и кипения (—87,42 °С), чем аммиак. Фосфин — чрезвычайно ядовитый газ с неприятным запахом.
Превращение пирамидальной молекулы Н3Р в тетраэдрический ион РН4+ должно сопровождаться существенным изменением валентного угла ÐНРН (от 93,7 до 109,5°), поэтому электронодонорные свойства Н3Р значительно ослаблены по сравнению с Н3N. Так, фосфин в воде растворяется, но соединений при этом не образует.
Электронодонорные свойства фосфин проявляет только при действии на него наиболее сильных доноров протонов (НСIО4, НI), например при смешивании газообразных Н3Р и НI:

При этом образуются малоустойчивые бесцветные кристаллические вещества производные иона фосфония РН4+. Водой соли фосфония легко разлагаются. Фосфин и производные фосфония сильные восстановители; фосфин на. воздухе самовоспламеняется (при 150 °С).
Аналогом гидразина является перфосфид водорода Н4Р2 (дифосфин):

Дифосфин — бесцветная жидкость (Тпл. —99 °С, Ткип. 65,2 °С). Образуется одновременно с Н3Р при гидролизе фосфидов. Сильный восстановитель, на воздухе самовоспламеняется.
 Соединения фосфора (I). По сравнению с РН4+ относительно более устойчивы комплексы, в которых наряду с атомами Н роль лигандов играют атомы О. Последние за счет p-связывания стабилизируют sр3-гибридное состояние фосфора:
Соединения фосфора (I). По сравнению с РН4+ относительно более устойчивы комплексы, в которых наряду с атомами Н роль лигандов играют атомы О. Последние за счет p-связывания стабилизируют sр3-гибридное состояние фосфора:
Все эти ионы имеют тетраэдрическое или искаженно тетраэдрическое строение. Учитывая различие в электроотрицательностях атомов, можно считать, что степень окисления фосфора в указанном ряду изменяется от —3 до +5,
В качестве соединений фосфора (I) можно рассматривать производные [РО2Н2]- - комплекса (гипофосфит -ион). Его водородное производное Н[РО2Н2]

в обычных условиях бесцветное кристаллическое вещество (Тпл. 26,5 °С), хорошо растворимое в воде. Водный раствор Н[РО2Н2] — сильная одноосновная кислота (К = 7,9×10-2), называемая фосфорноватистой.
Соли фосфорноватистой кислоты, называемые гипофосфитами, хорошо растворимы в воде. Как кислота, так и ее соли — сильные восстановители. При этом они окисляются до оксофосфатов (V). Гипофосфиты применяют в качестве восстановителей, например, при химическом никелировании:

Соединения фосфора (I) практически не проявляют окислительных свойств, но при нагревании они диспропорционируют:

Соединения фосфора (III). У производных фосфора (III) в образовании связей принимают участие три или четыре sр 3-гибридные орбитали атома фосфора, что соответствует пирамидальному и тетраэдрическому расположению связей. Так, молекула тригалогенида фосфора РНаl3 (как и Н3P) представляет собой тригональную пирамиду с атомом фосфора в вершине (d PHal = 0,155—0,255 нм, ÐНаlРНаl ~ 100 °):

| 
|
Оксид фосфора (III) Р2О3 существует в виде нескольких модификаций, построенных из пирамидальных структурных единиц.
Обычная форма Р2O3 имеет молекулярную решетку, образованную молекулами Р4O6. Эта форма легкоплавка (Тпл. 23,8°С, Ткип. 175,4°С), незначительно растворима в сероуглероде. Молекула Р4О6 состоит из четырех пирамид РО3, соединенных через атомы кислорода:

Другие модификации Р2О3 — полимерные соединения.
По химической природе бинарные соединения фосфора (III) являются кислотными, о чем свидетельствует их гидролиз:

И характер взаимодействия с основными соединениями:

При гидролизе образуется фосфористая кислота Н2[РО3Н]:
 Н
Н
а при взаимодействии с основными соединениями — соответствующие фосфаты (III). Производные нона [РО3Н]2- называются фосфитами. Большинство из них, кроме фосфитов s -элементов I группы, в воде растворяется плохо.
В обычных условиях Н2[РО3Н] — бесцветное, гигроскопичное, легко растворимое в воде твердое вещество (Tпл. 74 °С). В водном растворе — двухосновная фосфористая кислота. Это кислота средней силы (К1 = 1,6×10-3, К2 = 6,3×10-7). Обычно ее получают гидролизом РСl3.
 Соединения фосфора (III) — довольно сильные восстановители. Они, например, восстанавливают малоактивные металлы из растворов их соединений:
Соединения фосфора (III) — довольно сильные восстановители. Они, например, восстанавливают малоактивные металлы из растворов их соединений:
Фосфористая кислота окисляется до фосфорной галогенами, диоксидом азота и другими окислителями. Тригалогениды окисляются галогенами до РНаl5, кислородом до РОНаl3 и т. д.
Соединения фосфора (V). Фосфор проявляет степень окисления +5 в соединениях с галогенами, кислородом, серой и азотом, а также в соединениях смешанного типа.
Для фосфора (V) характерны координационные числа 4 и 6, реже 5. Следовательно, большинство из указанных выше соединений являются полимерными, так как их простейший состав не отвечает характерному для фосфора (V) координационному числу.
Относительно более просты по структуре пентагалогениды фосфора РНаl5. Их молекулы имеют форму тригональной бипирамиды:


Бинарные соединения фосфора (V) с кислородом, серой, азотом полимерны. Все они построены из тетраэдрических структурных единиц типа РХ4. (РО4, РS4, РN4).
 Оксид фосфора (V) Р2O5 в парообразном состоянии имеет состав Р4O10. Молекулы Р4О10 состоят из четырех тетраэдров РО4, каждый из которых связан с тремя соседними через общие атомы кислорода:
Оксид фосфора (V) Р2O5 в парообразном состоянии имеет состав Р4O10. Молекулы Р4О10 состоят из четырех тетраэдров РО4, каждый из которых связан с тремя соседними через общие атомы кислорода:
Твердый Р2O5 имеет несколько модификаций, отличающихся характером расположения тетраэдров РО4. При окислении белого фосфора образуется летучая модификация Р2O5 с молекулярной кристаллической решеткой, в узлах которой находятся молекулы Р4O10. Эта модификация легко возгоняется (Твозг. 359 °С), исключительно активно взаимодействует с водой. Другие модификации Р2О5 полимерны — образованы бесконечными слоями тетраэдров РО4. Они имеют более высокую температуру плавления (~580°С), химически несколько менее активны.
Оксид фосфора (V) Р2O5 получают сжиганием фосфора. Технический продукт имеет вид белой снегообразной массы, обычно состоящей из смеси разных форм Р2О5.
Оксид фосфора (V) очень активно взаимодействует с водой. Его используют для осушения газов а жидкостей, Он может отнимать воду у различных веществ; например, превращает НNО3 в N2О5 и даже H2SO4 в SO3. В качестве хорошего дегидратирующего средства оксид фосфора (V) широко используется в химическом синтезе.
Соответствующие Р2O5 оксофосфаты весьма разнообразны. Большое многообразие оксофосфатов объясняется тем, что тетраэдрические структурные единицы РО4 могут объединяться с соседними единицами РО4 посредством одной, двух или трех вершин:

Первый случай отвечает образованию димерного оксофосфат-иона Р2О74-, второй объединению тетраэдров РО4 в цепь (открытую или замкнутую), третий — образованию разветвленной цепи, На последнем принципе объединения основана, в частности, структура слоистых модификаций Р2O5. Все это показывает, что оксофосфаты (V) разнообразнее, чем оксосульфаты (VI), которые могут иметь лишь цепное строение.
Оксофосфаты (V) с открытой цепью (из 2—10 атомов Р) называют поли фосфатами, циклического строения — метафосфатами. Фосфаты с бесконечной открытой цепью называются полиметафосфатами.
Полифосфаты представляют собой соли анионов общей формулы [РnО3n+1](n+2)-. Например, М4+1Р2O7 диполифосфат (пирофосфат), M3+1Р3О10 — триполифосфат:


Рис.1 Строение оксофосфат (V)-ионов и слоистой модификации Р2О5:
1 – атом Р; 2 – концевой атом О; 3 – мостиковый атом О.
К метафосфатам относятся соли анионов общей формулы [РnО3n]n-. Например М3+1Р3O9 триметафосфат, М4+1Р4O12 — тетраметафосфат:

Так, при взаимодействии СаО с Р2О5. образуются Са3(РО4)2, Са2Р2О7, Са(РО3)2.
Рассмотрим гидратацию летучей модификации оксида фосфора (V) Р4O10. Как первую стадию гидратации можно рассматривать образование тетраметафосфорной кислоты: Р4О10 + 2Н2О = (НРО3)4

При дальнейшей гидратации тетраметафосфорная кислота превращается в тетраполифосфорную: (НРО3)4 + Н2О = Н6Р4О13

Далее происходит последовательное отщепление молекул Н3РО4 с образованием сначала триполифосфорной:
Н6Р4О13 + Н2О = Н3РО4 + Н5Р3О10

затем диполифосфорной (пирофосфорной):
Н5Р3О10 + Н2О = Н3РО4 + Н4Р2О7

и, наконец, ортофосфорной кислоты:
Н4Р3О7 + Н2О = Н3РО4 + Н3РО4
Гидратация нелетучих модификаций Р2O5 протекает сложнее — через образование других полифосфорных кислот; но в конечном итоге также образуется Н3РО4. Переход полифосфорных кислот в ортофосфорную ускоряется кипячением раствора, а также в присутствии сильных кислот.

Рис. 2
Состав фосфор-
ных кислот от
содержания в
растворе Р2О5
Простейшим представителем оксофосфатов водорода является Н3РО4. Молекула Н3РО4 имеет форму искаженного тетраэдра (d PO = 0,152 нм, d P-OH 0,157нм, ÐО= Р—ОН 112 ° и ÐHO – Р — ОН 106 °). В твердом и жидком Н3РO4 (т. пл. 42,3°С) молекулы объединяются за счет водородных связей.

Этим же обусловлена повышенная вязкость концентрированных растворов фосфорной кислоты.
Все оксофосфаты водорода — твердые вещества, хорошо растворимые в воде. Их растворы являются кислотами средней силы. Ортофосфорную кислоту получают в огромных количествах обычно в виде сиропообразного 85%-ного раствора взаимодействием фосфатных минералов с серной кислотой:

или гидратацией оксида фосфора (V). Ортофосфорная кислота — конечный продукт гидролиза всех соединений фосфора (V).
Полифосфорные кислоты образуются при взаимодействии Р2O5 с ортофосфорной кислотой. В системе Р2О5 - Н2О по мере увеличения содержания Р2О5 количество Н3РО4 уменьшается, а содержание полифосфорных кислот увеличивается.
При окислении влажного фосфора наряду с Р2О5 и Р2О3 образуется фосфорноватая (гексаоксодифосфорная) кислота Н4Р2О6,в которой степень окисления фосфора +4.

 НО ОН
НО ОН

 НО – Р – Р – ОН
НО – Р – Р – ОН

 О О
О О
Н4Р2О6 – кислота средней силы, все четыре атома водорода могут быть замещены на металл.
Н4Р2О6 + Н2О = Н3РО3 + Н3РО4 (фосфористая и ортофосфорная кислоты)
Основная масса фосфатов применяется в качестве удобрений. Так, Са(Н2РО4)2×Н2О составляет основу суперфосфата, а СаНРО4×2Н2О— преципитата. Смешанными азотнофосфорными удобрениями являются так называемые аммофос – смесь (NН4)Н2РО4 и (NН4)2HРО4 и азофоска – смесь аммофоса с КNО3.
Фосфаты в отличие от нитратов окислительные свойства не проявляют.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1585; Нарушение авторских прав?; Мы поможем в написании вашей работы!