
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Углерод
|
|
|
|
В зависимости от числа s-связей координационное число углерода равно четырем (sр 3-гибридизация), трем (sр 2-гибридизация) или двум (sр -гибридизация валентных орбиталей).

В большинстве соединений углерод четырехвалентен, ему приписывают степени окисления -4, +4, +2.
 В атоме углерода в отличие от всех других элементов число валентных электронов равно числу валентных орбиталей. Это одна из основных причин большой устойчивости связи С — С и исключительной склонности углерода к образованию гомоцепей. Наблюдается резкое уменьшение энергии связей от углерода к азоту:
В атоме углерода в отличие от всех других элементов число валентных электронов равно числу валентных орбиталей. Это одна из основных причин большой устойчивости связи С — С и исключительной склонности углерода к образованию гомоцепей. Наблюдается резкое уменьшение энергии связей от углерода к азоту:
что объясняют отталкиванием несвязывающих электронных пар атомов азота. Гомоцепные молекулы, содержащие связь С—С, бывают самых разнообразных типов: линейные, разветвленные, сшитые, циклические. Эти многочисленные соединения углерода изучаются в органической химии.
В природе углерод находится в виде двух стабильных изотопов: 12С(98,892 %) и 13С(1,108 %). Его содержание в земной коре 0,15 мол. доли, %. Под действием космических лучей в земной атмосфере образуется также некоторое количество b-радиоактивного изотопа 14С
 +
+  =
= 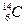 +
+ 
По содержанию 14С в растительных остатках судят об их возрасте. Получены также радиоактивные изотопы с массовыми числами от 10 до 16. В земной коре углерод находится в составе карбонатных минералов (прежде всего СаСО3 и МgСО3), каменного угля, нефти, а также в виде графита и реже алмаза. Углерод главная составная часть животного и растительного мира.
Простые вещества. В отличие от рассмотренных элементов 2-го периода, простые вещества которых имеют молекулярное строение F2, O2, N2, простые вещества элемента углерода имеют полимерное строение. Кратные связи двухатомных молекул О2 и N2 заметно прочнее, чем s-связи гомопепей (кДж/моль):

| 
|
Электронная конфигурация двухатомной молекулы С2: (ssсв)2(ssразр)2(py,zсв)4
свидетельствует о том, что в ней атомы связаны посредством двух связей. Связь в молекуле С2 оказывается менее прочной, чем две s-связи в гомоцепях (кДж/моль).
В соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединяться в полимерные образования координационной (sр 3), слоистой (sр 2) и линейной структуры (sр). Этому соответствуют несколько типов простых веществ: алмаз, графит и карбин, фуллерены.
Алмаз – кристаллическое вещество с атомной координационной кубической решеткой. Вследствие sp 3-гибридизации каждый атом в алмазе образует равноценные прочные s-связи с четырьмя соседними. Это обусловливает исключительную твердость и отсутствие электронной проводимости в обычных условиях (DЕ = 5,7 эВ). О жесткой структуре алмаза свидетельствует также очень небольшая величина энтропии алмаза — всего 2,4 Дж/(град×моль).
Графит — слоистое кристаллическое вещество с гексагональной структурой. В соответствии с sр 2-гибридизацией атомы углерода объединяются в макромолекулы С2∞, представляющие собой бесконечные слои из шестичленных колец. sр 2-Гибридное состояние в этом случае стабилизируется делокализованной p-связью, образованной за счет четвертого электрона каждого из атомов макромолекулы. p-Связь в графите делокализована в пределах всей макро- молекулы. Этим определяются его электрическая проводимость, серый цвет и металлический блеск. Углеродные слои объединяются в кристаллическую решетку в основном за счет межмолекулярных сил. Прочность химических связей в плоскости макромолекулы (716 кДж/моль) значительно больше, чем между слоями (всего 17 кДж/моль).
Рис.1. Структура алмаза (а) и графита (б)
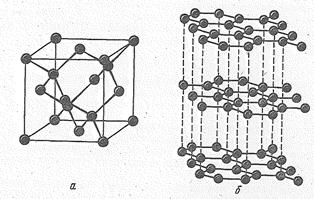
|  Рис. 2. Ориентация р-орбиталей атомов углерода макромолекулы С2¥.
Рис. 2. Ориентация р-орбиталей атомов углерода макромолекулы С2¥.
|
Поэтому графит довольно мягок, легко расслаивается, химически несколько активнее алмаза. Плотность графита (2,1—2,5 г/см3) ниже, чем алмаза (3,5 г/см3); энтропия, напротив, у графита больше и составляет 5,74 Дж/(град× моль).
Карбин — черный порошок (пл. 1,9—2 г/см3); его решетка гексагональная, построена из прямолинейных цепочек С∞, в которых каждый атом образует по две s– и p-связи. sр -Гибридизация орбиталей углерода отвечает объединению атомов в цепи вида
 Существование двух линейных структур доказано как физическими, так и химическими методами (в частности, при озонировании полиин превращается в щавелевую кислоту, а поликумулен — в угольную кислоту). Карбин — полупроводник (DЕ = 1 эВ). Под влиянием света его электрическая проводимость резко возрастает. Карбин синтезирован сравнительно недавно (в начале шестидесятых годов) советскими учеными. Позднее он был обнаружен в природе.
Существование двух линейных структур доказано как физическими, так и химическими методами (в частности, при озонировании полиин превращается в щавелевую кислоту, а поликумулен — в угольную кислоту). Карбин — полупроводник (DЕ = 1 эВ). Под влиянием света его электрическая проводимость резко возрастает. Карбин синтезирован сравнительно недавно (в начале шестидесятых годов) советскими учеными. Позднее он был обнаружен в природе.
В соответствии с возрастанием порядка связи между атомами углерода в ряду алмаз — графит — карбин межъядерное расстояние d CC в этом ряду уменьшается: 0,155; 0,142 и 0,128 нм. Расстояние между слоями в графите 0,335 нм. Расстояние между цепями в карбине 0,295 нм.
По значению стандартной энтропии модификации углерода располагаются в следующий ряд: Sкарбин> Sграфит >Sалмаз.
Из сопоставления теплот сгорания алмаза (-395,3 кДж/моль), графита (-393,5 кДж/моль) и карбина (-360,0 кДж/моль) следует, что наиболее стабильная модификация углерода — карбин, а наименее стабильная — алмаз. Вследствие очень высокой энергии активации превращения модификаций углерода возможны лишь при особых условиях. Так, алмаз превращается в графит при нагревании до 1000—1500 °С (без доступа воздуха). Переход графита в алмаз
Сграфит ® Салмаз, DН>0, DS<0
вследствие очень незначительного уменьшения объема в согласии с принципом Ле Шателье требует очень высокого давления (6×109—10×1010 Па). Повышение температуры неблагоприятно для смещения равновесия, но оно необходимо для достижения приемлемой скорости процесса. Процесс проводят при ~2000 °С.
В последние годы освоен метод получения алмаза при низком давлении. Наращивание алмаза осуществляется на алмазной затравке в атмосфере углеводородного газа (метан, этан) при температуре порядка 1000°С. Такой способ позволяет получать алмазный порошок или кристаллы алмаза в виде «усов». Образующиеся кристаллы отличаются высокой чистотой.
Получаемый при термическом разложении органических соединений черный графит, или уголь, представляет собой тонкоизмельченный графит. Технически наиболее важными сортами черного графита являются кокс, древесный уголь, животный уголь и сажа. Все разновидности углерода тугоплавки.
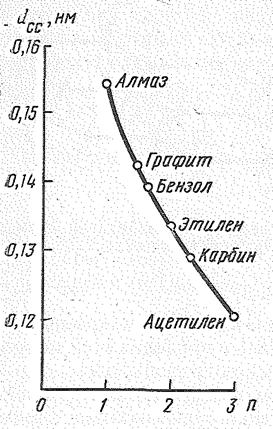
| При обычной температуре элементарный углерод весьма инертен. При высоких же температурах он непосредственно взаимодействует с многими металлами и неметаллами. Углерод проявляет восстановительные свойства, что широко используется в металлургии, Окислительные свойства углерода выражены слабо. Вследствие различия в структуре алмаз, графит и карбин по-разному ведут себя в химических реакциях. Для графита характерны реакции образования кристаллических соединений, а которых макромолекулярные слои С2¥ играют роль самостоятельных радикалов. Рис.3 Влияние кратности связи (n) на межъядерное расстояние dCC. |
Так, при взаимодействии с фтором нелокализованная p-связь графита разрывается и возникают двухэлектронные s-связи С—F. В пределе образуется фторид графита состава СF (рис. 4). При этом углерод переходит из sр 2- в sр 3-гибридное состояние. Поскольку во фториде графита все связи локализованные, он диэлектрик. Фторид графита бесцветное, прозрачное, химически инертное вещество. Не реагирует даже с концентрированными кислотами и щелочами. Используется как смазочный материал. При дальнейшем окислении фтором превращается в СF4. Алмаз окисляется фтором при нагревании непосредственно до СF4. На различном отношении ко фтору основан один из способов отделения графита от алмаза, полученный синтезом.
При нагревании графита в парах или в расплаве щелочного металла (Са, Rb или К) образуются соединения включения — графитиды щелочных металлов, в которых роль аниона играют гексагональные сетки С2¥. Структура графитида калия состава КС8 показана на рис. 4. Графитиды МС8 — весьма реакционноспособные вещества меднокрасного цвета. Самовоспламеняются на воздухе, а с водой взаимодействуют со взрывом.
Соединения типа включения образуются также при взаимодействии графита с другими веществами (НNО3, Н2SO4, Сl2, FеСl3 и др.).
 Рис.4 Структура фторида графита СF.
Рис.4 Структура фторида графита СF.
|  Рис.5 Структура графита состава КС4.
Рис.5 Структура графита состава КС4.
|
Из графита изготовляют электроды, плавильные тигли, футеровку электрических печей и промышленных электролизных ванн и др. В ядерных реакторах его используют в качестве замедлителя нейтронов. Графит применяется также как смазочный материал и т. д.
Исключительная твердость алмаза обусловливает его широкое применение для обработки особо твердых материалов, при буровых работах, для вытягивания проволоки и т. д. Наиболее совершенные кристаллы алмаза используют после огранки и шлифовки для изготовления ювелирных изделий (бриллиантов).
Благодаря большой адсорбционной способности древесного и животного углей они применяются для очистки веществ от примесей, Сажа используется в производстве черной резины, для изготовления красок, туши и т. д.
Сочетание атомов углерода разных гибридных состояний в единой полимерной структуре порождает множество аморфных форм углерода. Типичным примером аморфного углерода является так называемый стеклоуглерод. В нем беспорядочно связаны между собой структурные фрагменты алмаза, графита и карбина. Его получают термическим разложением некоторых углеродистых. веществ. Стеклоуглерод — новый конструкционный материал с уникальными свойствами, не присущими обычным модификациям углерода. Стеклоуглерод тугоплавок (остается в твердом состоянии вплоть до 3700 оС)., по сравнению с большинством других тугоплавких материалов имеет небольшую плотность (до 1,5 г/см3), обладает высокой механической прочностью, электропроводен. Стеклоуглерод весьма устойчив во многих агрессивных средах (расплавленных щелочах и солях, кислотах, окислителях и др.). Изделия из стеклоуглерода самой различной формы (трубки, цилиндры, стаканы и пр.) получают при термическом разложении углеродистых веществ или прессованием стеклоуглерода. Уникальные свойства стеклоуглерода позволяют использовать его в атомной энергетике, электрохимических производствах, для изготовления аппаратуры для особо агрессивных сред. Стекловидное углеродистое волокно, обладая низкой плотностью, высокой прочностью на разрыв и повышенной термостойкостью, может найти применение в космонавтике, авиации и других областях.
Соединения с отрицательной степенью окисления углерода. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода -4. По типу химической связи можно выделить ковалентные, ионно-ковалентные и металлические карбиды.
Ковалентные карбиды кремния SiС и бора В4С полимерные вещества. Они характеризуются очень высокой твердостью, тугоплавкостью и химической инертностью.
В качестве простейшего ковалентного карбида можно рассматривать метан СН4. Его молекула имеет тетраэдрическую форму (d CH = 0,1093 нм, m = 0), что отвечает электронной конфигурации - (ssсв)2(sхсв)2(sусв)2(szсв)2.
Метан — бесцветный, не имеющий запаха газ (Тпл. -182,48 °С, Ткип. -161,49 °С), химически весьма инертен вследствие валентной и координационной насыщенности молекулы. На него не действуют кислоты и щелочи. Однако он легко загорается; его смеси с воздухом чрезвычайно взрывоопасны. Метан — основной компонент природного, рудничного и болотного газа. Содержится в виде клатратов в земной коре. В больших количествах образуется при коксовании каменного угля. Богатые метаном газы используются как высококалорийное топливо и сырье для производства водяного газа.
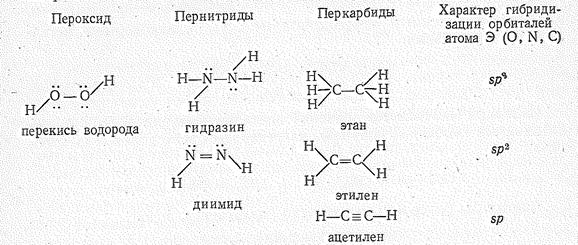
Углерод образует многообразные перкарбиды. Вследствие высокой прочности гомоцепей из атомов углерода перкарбиды многообразнее пероксидов и пернитридов. В качестве простейших представителей перкарбидов можно формально рассматривать некоторые простейшие углеводороды изоэлектронные аналоги пероксида и пернитридов водорода.
Этан С2Н6, этилен С2Н4 и ацелилен С2Н2 в обычных условиях — газы. Вследствие высокой прочности связи С2Н6 (ЕСС = 347 кДж/моль), С2Н4 (ЕСС = 598 кДж/моль) и С2Н2 (ЕСС = 811 кДж/моль) в отличие от Н2О2, и N2H4 в особенности N2Н2 вполне устойчивы и химически малоактивны.
Расстояния dCC при одинарной, двойной и тройной связях между атомами углерода равны 0,154, 0,135 и 0,120 нм, а силовые постоянные kСС – соответственно 450, 960 и 156 Н/м. В зависимости от типа гибридизации орбиталей атома углерода длина связи С-Н составляет: 0,1093 нм (sр 3-гибридизация), 0,1071 нм (sр 2-гибридизация), 0,1057 нм (sр -гибридизация). Межъядерное расстояние в ионе С22- составляет 0,119—0,124 нм.
Ионно-ковалентные карбиды —это бесцветные прозрачные кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов.
В качестве производных метана – метанидов – можно рассматривать карбиды Ве2С (Тпл. 2150 оС) и Al4C3 (Тпл. 2800°С). Это тугоплавкие кристаллические вещества. Согласно рентгеноструктурным исследованиям в их кристаллах атомы углерода между собой не связаны. Метаниды водой разлагаются, выделяя метан:
А14С3 (к) + 12Н2О (ж) = 4А1(ОН)3 (к) + 3СН4 (г), DGo298 = —1770 кДж/моль.
Из солеподобных перкарбидов относительно лучше изучены ацетилиды типа М+12С2, М+2С2 и М+32(С2)3. Ацетилиды наиболее характерны для s и d-элементов I и II групп, а также для алюминия.
Ацетилиды образуются по обменным реакциям в растворах
2АgNО3 + Н2С2 = Аg2С2¯ + 2НNO3
или непосредственным взаимодействием С2Н2 с некоторыми металлами при нагревании:
2Аl + 3С2Н2 = Аl2(С2)3 + 3Н2; Zn + С2Н2 = ZnС2 + Н2
Имеющий наибольшее значение ацетилид кальция СаС2 (обычно называемый карбидом кальция) получают нагреванием СаО с углем в электропечах:
СаО + 3С = СаС2 + СО, DНo298 = 468 кДж/моль.
СаС2 + N2 = СаСN2 + C.
Окислением карбида кальция азотом при нагревании можно получить цианамид кальция - СаСN2, который применяется в качестве удобрения, а также для получения аммиака и ряда азотистых производных углерода.
Ацетилиды более или менее легко разлагаются водой:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
с образованием ацетилена. При этом производные s-элементов I группы взрывают. Ацетилиды d-элементов I и II групп (Сu2С2, Аg2С2, Аu2С2, НgС2) взрывают и в сухом состоянии. Ацетилид кальция СаС2 используется в технике для получения ацетилена.
В ряду F – О – N – C повышается способность к образованию соединений с делокализованной связью, вплоть до металлической. Металлическими Килюются карбиды d -элементов IV—VIII групп. Карбиды этого типа представляют собой соединения включения; в них атомы углерода занимают октаэдрические пустоты в плотноупакованных структурах атомов металлов.
Металлические карбиды весьма разнообразны. Чаще всего встречаются карбиды среднего состава МС (ТiС, ZrС, НfС, VС, NbС, TаС), М2С (Мo2С,W2С), М3С (Мn3С, Fе3С, Со3С). Эти карбиды проявляют металлические признаки: металлический блеск, высокую электрическую проводимость, уменьшающуюся с повышением температуры, легкость образования твердых растворов с металлами и др. Состав карбидов d -элементов изменяется в широких пределах. Например, в зависимости от условий получения карбиды титана и ванадия имеют состав ТiС0,6-1,0 и VС0,58-1,0.
Карбиды d -элементов обладают высокой твердостью, жаропрочностью, обычно более высокой температурой плавления, чем исходные металлы, например:

Карбиды состава МС (ТiС, VС, NbС) и М2С (Мо2С, W2С) наряду с Килюючительной жаростойкостью и тугоплавкостью (2000—3500 °С) характеризуются высокой коррозионной стойкостью.
Карбиды состава М3С (Мn3С, Fе3С, Со3С) термически и химически менее устойчивы. Так, они разлагаются разбавленными кислотами, выделяя смесь углеводородов.
Карбиды получают прокаливанием при высоких температурах смеси порошков металлов или их оксидов с углем в электрических печах:
V2O5 + 7С = 2VС + 5СО.
Металлические карбиды входят в состав чугунов я сталей, придавая им твердость, износоустойчивость и другие ценные качества, На основе карбидов вольфрама, титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов. Такие сплавы изготовляют методами порошковой металлургии (спрессовыванием составных частей при нагревании); в качестве цементирующего материала чаще всего используют кобальт и никель. Сплав, состоящий из 20% НfС и 80% ТаС, — самый тугоплавкий из известных веществ (Tпл. 4400 °С).
Соединения углерода (IV). Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллическими элементами: СНаl4, СО2, СS2, СОНаl2, СSНаl2. В соответствии с гибридным состоянием валентных орбиталей углерода молекулы его галогенидов СНаl4 имеют тетраэдрическую, молекулы оксида СО2 и сульфида СS2 линейную, а оксо- и сульфидогалидов СОНаl3 СSНаl2 — треугольную структуру:
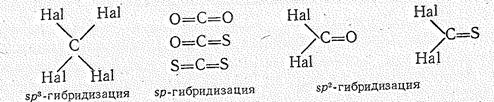
В обычных условиях некоторые из указанных соединений газы (СF4, СО2, СОS, СОСl2), другие — жидкости (ССl4, СS2) или легкоплавкие твердые вещества (СВr4, CI4). В твердом состоянии все они имеют молекулярные решетки.
По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них довольно легко взаимодействуют с водой, образуя Кислоты:
СО2 + Н2О = Н2СО3
СОCl2 + 2H2O = Н2СО3 + 2HCl
и с основными соединениями, образуя соли:
2KOH + CO2 = K2CO3 + H2O;
2KNH2 + CO2 = K2CN2 + 2H2O в жидком аммиаке;
CaS + CS2 = CaCS3;
Ca3N2 + C3N4 = 3CaCN2 в жидком аммиаке.
Некоторые константы тетрагалогенидов углерода приведены ниже:

В обычных условиях СF4 — газ, ССl4 — жидкость, а СВr4 и СI4— твердые вещества, Первые два галогенида бесцветны, СВr4 — бледно-желтое и СI4 — светло-красное вещества. Все эти соединения практически в воде нерастворимы, но растворяются в органических растворителях. Тетрафторид углерода чрезвычайно устойчив к нагреванию и химическим реагентам, тетрахлорид несколько менее устойчив, однако не разлагается щелочами и кислотами. Его гидролиз протекает лишь при высокой температуре в присутствии катализаторов (металлов). Изменение энергии Гиббса в реакции
СНаl4 (г) + 2Н2O (г) = СО2 (г) + 4ННаl (г)
свидетельствует о термодинамической вероятности гидролиза СF4 (DG0298 = -150 кДж/моль) и ССl4 ((DG0298 = -251 кДж/моль). Отсутствие гидролиза при обычных условиях обусловливается кинетическим фактором: координационно насыщенный атом углерода не склонен присоединять молекулы воды (акцептировать электронные пары от молекул Н2О для инициирования гидролиза).
По мере увеличения длины и ослабления прочности связи С—Наl в ряду СF4 — ССl4 — СВr4 — Сl4 устойчивость соединений снижается и возрастает химическая активность.
Тетрафторид углерода можно получить непосредственным взаимодействием простых веществ или по обменной реакции между ССl4 и АgF при 300 °С. Тетрахлорид получают хлорированием СS2 (а СS2 получают при пропускании паров S над раскаленным древесным углем) в присутствии катализатора:
СS2 + 3Cl2 = CCl4 + S2Cl2
Из тетрагалидов наибольшее применение получил ССl4 в качестве негорючего растворителя органических веществ, а также жидкости для огнетушителей. Смешанный фторид-хлорид углерода ССl2F2 — фреон (т. пл. —30 °С) применяется в качестве хладоагента в холодильных машинах и установках.
Молекула диоксида углерода СО2 имеет линейную форму (d CO = 0,1162 нм, m = 0). Это отвечает электронной конфигурации:
(2sa)2(2sb)2(ssсв)2(sxсв)2(py,xсв)4(py,x)4.
 Связи в молекуле СО2 осуществляются за счет четырех электронных пар на четырех трехцентровых орбиталях. В представлениях теории локализованных связей это отвечает расположению четырех электронных пар на четырех двухцентровых орбиталях:
Связи в молекуле СО2 осуществляются за счет четырех электронных пар на четырех трехцентровых орбиталях. В представлениях теории локализованных связей это отвечает расположению четырех электронных пар на четырех двухцентровых орбиталях:
две из которых s-типа и возникают за счет перекрывания двух sр -гибридных орбиталей С и двух 2 р x-орбиталей О. Две другие локализованные орбитали p-типа возникают при перекрывании 2 р y и 2 р z-орбиталей С с 2 р y- и 2 р z-орбиталями О. Роль неподеленных электронных пар атомов кислорода играют несвязывающие 2 s а-, 2 s b- и px,z-электроны.
Для реакции С (графит) + О2 (г) = СО2 (г)
изменение энтропии незначительно (DS ~ 0), поэтому изменение энергии Гиббса по существу обусловлено изменением энтальпии, т. е. DН@DG. Следовательно, теплоту этой реакции почти полностью можно использовать для совершения работы. Это можно достигнуть, если суметь осуществить реакцию в топливном элементе. При использовании же реакции горения угля в системе «топка — паровой котел — турбина — электрический генератор» коэффициент полезного действия составляет лишь 20—30%.
Диоксид углерода (Тсубл. -78,5 °С, Тпл. -56,5 °С при 5×105 Па) в технике обычно получают термическим разложением СаСО3, а в лаборатории — действием на СаСО3 соляной кислотой.
Растворимость СО2 в воде невелика (при 0°С составляет 1,7 л СО2, при 15 °С — 1 л СО2 в 1 л воды). Некоторая часть растворенного СО2 взаимодействует с водой с образованием угольной кислоты Н2СО3. Диоксид очень легко поглощается растворами щелочей; при этом образуется соответствующий карбонат, а при избытке СО2 — гидрокарбонат:
2ОН- + СО2 = СО32- + Н2О; ОН- + СО2 = НСО3-.
Диоксид углерода используют в производстве соды, для тушения пожаров, приготовления минеральной воды, как инертную среду при проведении различных синтезов.
Дисульфид углерода СS2 (сероуглерод) в обычных условиях —летучая бесцветная жидкость (Тпл. -111,6 °С, Ткип. -46,3 °С). Получают его взаимодействием паров серы с раскаленным углем. Сероуглерод — эндотермическое соединение (DНо = + 122 кДж/ моль), легко окисляется, при небольшом нагревании воспламеняется на воздухе:
СS2 + 3O2 = CO2 + 2SO2
В воде СS2 не растворяется, при нагревании (150 °С) гидролизуется на СО2 и Н2S. Сероуглерод используется как хороший растворитель органических веществ, фосфора, серы, иода. Основная масса СS2 применяется в производстве вискозного шелка, а также в качестве средства для борьбы с вредителями сельского хозяйства. Сероуглерод ядовит!
Из оксодигалидов углерода (IV) известны СОF2, СОСl2 и COBr2. Их молекулы имеют форму плоского треугольника. Поскольку связи в них неравноценны, молекулы СОНаl2 обладают полярностью.

Все оксодигалиды (карбонилгалиды) значительно более реакционноспособны, чем тетрагалиды; в частности, они легко гидролизуются. Наибольшее применение находит COCl2 (фосген, хлористый карбонил). Его широко используют в органическом синтезе. Это чрезвычайно ядовитый газ.
Из анионных комплексов углерода (IV) — карбонатов — простейшими являются СО32-, СS32- и СN22-:

Оксокарбонаты получают взаимодействием СО2 с растворами щелочей или по обменным реакциям. Растворимы в воде лишь карбонаты натрия и элементов подгруппы калия. При действии СО2 на карбонаты в присутствии воды образуются гидрокарбонаты:
СаСО3 (т) + СО2 (г) + Н2О (ж) «Са(НСО3)2 (р)
Гидрокарбонаты в отличие от карбонатов в большинстве своем растворимы в воде.
Один из основных продуктов химической промышленности – сода Na2CO3. (В виде кристаллогидрата - Na2CO3×10Н2О, вода легко выветривается и теряет часть кристаллизационной воды.) Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и др. отраслями промышленности. А также служит для получения различных солей натрия. В быту применяется главным образом как моющее средство. Получают соду аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе.
Концентрированный раствор NaCl насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известныка. При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония NH3 + CO2 + H2O = NH4HCO3 который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
NH4HCO3 + NaCl = NaHCO3¯ + NH4Cl.
Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь вступающий в производство:
2NaHCO3 = Na2CO3 + CO2 + 2H2O
Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак, который также возвращается в производство:
2NH4Cl + Сa(OH)2 = 2NH3 + CaCl2 + 2H2O.
Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение (получение Са, для осушки газов и жидкостей, для ускорения твердения бетона). Полученный по аммиачно-хлоридному способу карбонат натрия не содержит кристаллизационной воды и называется кальцинированной содой.
Часть гидрокарбоната натрия используется без дальнейшей переработки (под название питьевая или двууглекислая сода) в медицине, хлебопечении или пищевой промышленности.
Карбонат калия или поташ, К2СО3 представляет собой белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде. Применяется для получения мыла, при изготовлении тугоплавкого стекла. Поташ получают действием диоксида углерода на раствор гидроксида калия, образующийся при электролизе раствора хлорида калия:
2КОН + СО2 = К2СО3 + Н2О
Триоксокарбонат водорода Н2СО3 известен только в разбавленном водном растворе (угольная кислота). Образуется при взаимодействии СО2 с водой. В водном растворе большая часть растворенного СО2 находится в гидратированном состоянии СО2×aq и только часть в виде Н2СO3, НСО3- и СО32-. Угольная кислота — кислота довольно слабая (К1 = 1,31×10-4, К2 = 4,84×10-11).
Большее значение имеет мочевина СО(NН2)2 — белое кристаллическое вещество (Tпл. 132,7°С). Ее получают действием СО2 на водный раствор H3N при 130 °С и 1×107 Па:
СО2 + 2Н3N = СО(NH2)2 + Н2O
Мочевина применяется в качестве удобрения и для подкормки скота. Это исходный продукт для получения пластических масс, фармацевтических препаратов (веронала, люминала и др.) и пр.
Сульфидокарбонаты (IV) (тиокарбонаты) в многом напоминают триоксокарбонаты (IV). Их можно получить взаимодействием сероуглерода с основными сульфидами, например:
К2S + СS2 = К2[СS3]
Трисульфидокарбонат водорода Н2СS3 -маслянистая жидкость (Тпл. -31°С). Образуется действием на соответствующие тиокарбонаты соляной или серной кислот:
К2СS3 + 2НСl = Н2СS3 + 2КСl
Водный раствор Н2СS3 — слабая твоугольная кислота. Постепенно разлагается водоq, образуя угольную кислоту и сероводород:
Н2СS3 + 3Н2О = Н2СО3 + 3Н2S
Известны также смешанные оксосульфидокарбонаты — производные комплексов [СОS2]2- и [СО2S]2-.
Из нитридокарбонатов важное значение имеет так называемый цианамид кальция СаСN2, Его получают окислением карбида кальция СаС2 азотом при нагревании:
СаС2 + N2 = СаСN2 + С
Цианамид кальция применяют в качестве удобрения, а также для получения аммиака и ряда азотистых производных углерода.
Динитридокарбонат водорода Н2СN2 (цианамид) (NH2CN) — бесцветные кристаллы (Tпл. +46 °С), легко растворимые в воде, спирте и эфире. Цианамид проявляет слабовыраженные кислотные свойства. В органических растворителях вероятно равновесие таутомерных форм:

В воде Н2СN2 постепенно разлагается на угольную кислоту и аммиак.
NH2CN + 3H2O = 2NH3 + H2CO3
Жидкий цианамид полимеризуется, давая кольцеобразные тримерные молекулы меламина:

| 
|
Выше приведены структурные формулы нитридо- и оксонитридокарбонатов водорода, которые можно рассматривать как производные Н2СО3, где ОН- и O-2 замещены на NН2- и NН2- -радикалы.
sр -Гибридному состоянию углерода кроме СN22- соответствуют также анионы СОN- и CSN-: [N=С=N]2-, [О=С=N]-, [S=С=N]-.
Производные СNО- и СNS- называют соответственно цианатами и роданидами[1]. Оксонитридокарбонат (IV) водорода НСNO в водном растворе (циановая кислота, К = 1,2×10-4) существует в виде таутомерных форм:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3674; Нарушение авторских прав?; Мы поможем в написании вашей работы!