
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Большинство боранов имеет отвратительный запах и очень ядовиты!
|
|
|
|
Бор
0 +5 +4 +2
....
H—O—CºN «O=C=N—Н
Многие нитридо- и оксонитридокарбонаты водой постепенно разрушаются, выделяя аммиак:
КСNO + 2Н2О = КНСО3 + Н3N
СаСN2 + 3Н2О (пар) = СаСО3 + 2Н3N
Последняя реакция используется для получения аммиака по цианамидному способу.
Сульфидонитридокарбонат (IV) водорода НСNS (роданид водорода H—S—СºN — бесцветная очень неустойчивая маслянистая жидкость (T пл. 5°С). С водой смешивается в любых соотношениях, образуя сильную (типа НСl) роданистоводородную кислоту (К = 0,14).
Роданиды в основном применяют при крашении тканей; NН4СNS испольуют как реактив на ноны Fе3+.
Карбонат (IV)-ионы, особенно СNО- и СNS-, могут играть роль лигандов в комплексных соединениях, например К3[Fе(NСS)6], Na2[Ni(СNО)3].
Ионы СNO- и СNS- — монодентатные лиганды, а ион СО32- может выступать а качестве как монодентатного, так и дидентатного лиганда:

Для углерода (IV) известны многочисленные гетероцепные соединения, например, ряда:
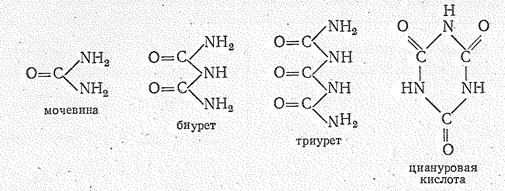
Это кристаллические вещества; в основном они используются в органическом синтезе.
Соединения углерода (II). Производные углерода (II) это СО, СS, НСN. В молекуле оксида углерода (II) СО, как и в изоэлектронной ей молекуле N2, имеется тройная связь. В интерпретации теории валентных связей две связи образованы за счет спаривания 2 р -электронов атомов С и О, третья — по донорно-акцепторному механизму за счет свободной 2 р -орбитали углерода и 2 р -электронной пары кислорода:

Согласно теории молекулярных орбиталей это отвечает следующей электронной конфигурации невозбужденной молекулы СО:
(ssсв)2 (ssразр)2 (py,xсв)4 (sхсв)2 .
Эту электронную конфигурацию можно интерпретировать следующим образом. Три занятые s-орбитали соответствуют двум парам электронов (одна из них преимущественно локализована у атома углерода, вторая — около атома уислорода) и одной s-связи между атомами углерода и кислорода. Дважды вырожденный pсв-уровень соответствует образованию двух p-связей. Молекула СО характеризуется очень большой энергией диссоциации (1069 кДж/моль), высоким значением силовой постоянной связи (kCO = 1860 Н/м) и малым межъядерным расстоянием (0,1128 нм). Электрический момент диполя молекулы СО незначителен (m = 0,04×10-29 Кл×м); при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода — положительный.
Поскольку строение молекул СО и N2 аналогично, сходны и их физические свойства: очень низкие температуры плавления (для СО -204 oС) и кипе- ния (-191,5 °С); стандартные энтропии близки (для СО 197,3 кДж/град×моль, N2 191,3 кДж/град×моль); в твердом состоянии оксид углерода (II), как и азот, существует в виде двух модификаций (кубической и гексагональной); плохо растворяются в воде и т. д. Сходство проявляется также структуре спектров СО и N2. Оксид углерода (II) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем:
СО2 (г) + С (к) = 2СО (г), DН = 120 кДж, DS = 176 Дж/(град×молъ).
Оксид углерода (II) очень ядовит, и особенно опасен тем, что не имеет запаха и цвета. Ядовитое действие СО объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшийся карбоксигемоглобин постепенно разрушается и гемоглобин восстанавливает способность поглощать кислород.

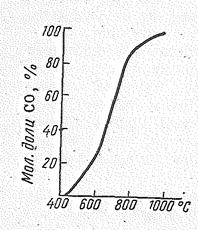
| Эта реакция обратима, ее протекание вправо определяет энтропийный фактор, протекание влево — энтальпийный фактор. Равновесие этой реакции ниже 400 °С практически смещено в сторону образования СО2, выше 1000 °С— в сторону образования СО. Скорость реакции при низкой температуре незначительна, поэтому в обычных условиях оксид углерода (II) не диспропорционирует, т. е. вполне устойчив. Рис.5. Влияние температуры на состояние равновесия: СО2 (г) + С (к) = 2СО (г) |
В обычных условиях оксид углерода (II) химически весьма инертен. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии. При 700 oС оксид углерода сгорает синим пламенем, выделяя большое количество тепла (282 кДж/моль):
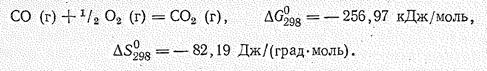
При нагревании СО окисляется серой:
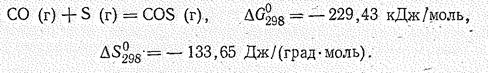
При облучении или в присутствии катализатора СО взаимодействует с хлором, образуя оксохлорид СОСl2 (фосген – чрезвычайно ядовитый газ) и т. д. Фосген важный промышленный продукт, он применяется при синтезе ряда органических и неорганических веществ, например красителей.
СО + Cl2 = COCl2.
Оксид углерода (II) соединяется со многими металлами, образуя карбонилы металлов - Fe(CO)5, Ni(CO)4 (обе летучие, весьма ядовитые жидкости) и т.д. Химические связи в молекулах карбонилов металлов образованы по донорно-акцепторному способу, за счет неспаренных электронных пар молекулы СО.
Молекула СО может выступать в качестве лиганда в различных комплексах. При этом за счет несвязывающей электронной пары углерода она проявляет s-донорные, а за счет свободных pразр-орбиталей — p-акцепторные свойства.
Аналогично молекуле СО построен изоэлектронный ей цианид-ион СN-. Электронную конфигурацию невозбужденного состояния нона СN-
(ssсв)2 (ssразр)2 (py,xсв)4 (sхсв)2 .
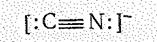 можно интерпретировать так же, как и электронную конфигурацию молекулы СО. Две занятые ss-орбитали соответствуют двум парам электронов, одна из которых преимущественно локализована у атома азота, другая — около атома углерода. Занятая sхсв-орбиталь соответствует s-связи, а четыре электрона на дважды вырожденном pсв-уровне двум p-связям между атомами С и N:
можно интерпретировать так же, как и электронную конфигурацию молекулы СО. Две занятые ss-орбитали соответствуют двум парам электронов, одна из которых преимущественно локализована у атома азота, другая — около атома углерода. Занятая sхсв-орбиталь соответствует s-связи, а четыре электрона на дважды вырожденном pсв-уровне двум p-связям между атомами С и N:
Цианиды получают восстановлением углеродом карбонатов (IV) при нагревании:
Na2C+4O3 + C0 +2H3N = 2NaC+2N + 3H2O
CaC+4N2 + C0 + Na2CO3 = CaCO3 + 2NaC+2N
По химической природе цианиды могут быть основными и кислотными. Так, при гидролизе ионный цианид NаСN образует щелочную среду, а ковалентный IСN — две кислоты:
NаСN + НОН «NаОН + НСN; IСN + НОН = НIО+ НСN
основный кислотный
Цианиды d -элементов в воде не растворяются, но за счет комплексообразования легко растворяются в присутствии основных цианидов:
4КСN + Мn(СN)2 = К4[Мn(СN)6].
Образование цианидных комплексов объясняется так же, как и карбонильных. В образовании связей принимают участие все валентные электроны и орбитали d -элемента (за счет донорно-акцепторного и дативного механизмов). Например, распределение валентных электронов в ионах [Fе(СN)6]4- и [Со(СN)6]3- аналогично распределению в изоэлектронной им молекуле Сr(СО)6.
Вследствие наложения s- и p-составляющих связь 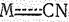 обладает высокой прочностью, а цианидные комплексы отличаются очень малой величиной константы нестойкости:
обладает высокой прочностью, а цианидные комплексы отличаются очень малой величиной константы нестойкости:

Эти величины намного (на несколько порядков) ниже, чем для соответствующих аммиакатов, фторидных и других комплексов.
Цианид-ион, будучи отрицательно заряженным, относительно плохой p-акцептор. Поэтому цианидные комплексы металлов в низких степенях окисления не так устойчивы, как соответствующие карбонильные производные. С другой стороны, благодаря наличию заряда СN--ион как s-донор сильнее, чем СО, и поэтому образует относительно устойчивые производные с металлами в высокой степени окисления, например [Мо+4(СN)8]4-.
Молекула цианида водорода НСN имеет линейную структуру (d CH = 0,106 нм, d CN = 0,116 нм). (а) Существует также ее таутомерная форма (изоцианид водорода) (б).
 а а
| 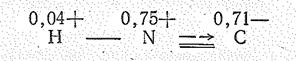 б б
|
Первый изомер устойчивее, так как эффективные заряды на атомах имеют меньшее значение, чем во втором.
Молекулы НСN обладают высокой полярностью (m =0,9×10-29 Кл×м), за счет водородной связи они ассоциируются в бесцветную жидкость (т. пл. —13,3 °С, т. кип. 25,7 °С). Цианид водорода смешивается с водой в любых отношениях. Его водный раствор очень слабая кислота (К = 7,9×I0-10), называемая синильной или цианистоводородной.
Цианид водорода соединение эндотермическое (DН0f = 135 кДж/моль, DG0f = 125,5 кДж/моль). Жидкий НСN постепенно полимеризуется.
Будучи производными углерода (II), цианиды проявляют восстановительные свойства. Так, при нагревании их растворов они постепенно окисляются кислородом воздуха, образуя цианаты:
2C+2N- + O2 = 2С+4NО-
а при кипячении растворов цианидов с серой образуются роданиды,
С+2N- + S = С+4NS-.
На последней реакции основано получение роданидов.
Цианиды получают восстановлением углеродом карбонатов (IV) при нагревании:
Na2C+4O3 + C0 + 2H3N = 2NaC2+N + 3H2O;
Na2C+4O3 + C0 + CaC+4N2 = CaCO3 + 2NaC2+N,
а также по реакциям, не сопровождающимся окислением-восстановлением элементов. Так, в частности, получают в технике НСN при нагревании смеси СО и Н3N под давлением в присутствии катализатора (ТhO2):
CO + H2NH = HCN + H2O
Цианид водорода применяют в органическом синтезе, NаСN и КСN — при добыче золота, для получения комплексных цианидов и т. д. Цианиды чрезвычайно ядовиты!
При нагревании цианидов малоактивных металлов (АgСN, Нg(СN)2) до 350—450 °С образуется дициан (СN)2:
Hg(CN)2 = Hg + (CN)2.
Это очень реакционноспособный ядовитый газ (Tпл. -34,4 oС, Tкип. -21,2 °С). Свойства дициана (d CC = 0,137 нм, d CN =0,113 нм) отвечают структуре
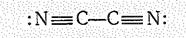
Эненргия Гиббса образования дициана имеет большое положительное значение (DG0f = +309,2 кДж/моль), поэтомк непосредственным взаимодействием простых веществ он не получается. По этой же причине дициан легко окисляется кислородом, давая очень горячее пламя (~ 4780 оС). Дициан можно назвать псевдогалогеном, так как в некоторых реакциях он ведет себя подобно галогену. Так, при взаимодействии дициана с водородом образуется газ НСN
(CN)2 + H2 = 2HCN,
который, как и ННаl, в растворе ведет себя как кислота. Подобно галогенам, дициан при действии щелочей диспропорционирует:
(CN)2 + 2OH- = CN- + CNO- + H2O.
Дициан может выступать и в качестве восстановителя:
(CN)2 + Cl2 = 2CNCl.
В чистом виде дициан устойчив, но при нагревании полимеризуется:
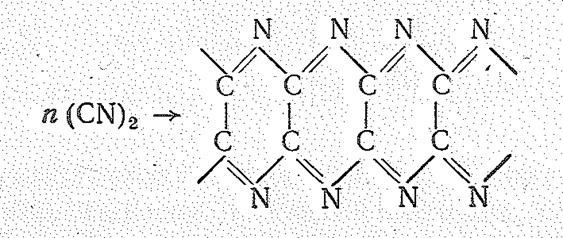
Хлорид циана СNCl в обычных условиях газ (Tпл. -6 °С, Tкип. 1З,8°С). Это соединение ковалентное, по химической природе — кислотное,
При взаимодействии со щелочами дает цианат- и хлорид-ионы:
СNCl + 2OН- = СNО- + Сl- + Н2O.
[1] Родан по-гречески – розовый.
3Si + 4НNО3 + 18НF = 3Н2SiF6 + 4NО + 8Н2O
В этой реакции НNО3 играет роль окислителя, а НF комплексообразующей среды. В результате реакции кремний переходит в устойчивую степень окислений +4; входит в состав устойчивого фторокомплекса SiF62-.
Кремний энергично растворяется в щелочах с выделением водорода:
0 +1 +4 0
Si + H2O + 2KOH = K2SiO3 + 2H2
При этом роль окислителя выполняет вода, а комплексообразующей среды — ОН- -ионы.
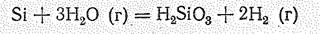 С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс
С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс
Окислительная активность кремния проявляется лишь по отношению к некоторым металлам, например:
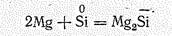
Кремний технической чистоты (95—98 %) получают в электропечах восстановлением SiО2 с помощью кокса. В лаборатории в качестве восстановителя применяют магний. При этом образуется сильно загрязненный примесями коричневый порошок кремния. Последний перекристаллизацией из металлических расплавов (Zn, Аl и др.) можно перевести в кристаллическое состояние. Необходимый для полупроводниковой техники кремний особой чистоты получают восстановлением SiСl4 цинком при высокой температуре:
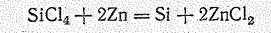
а также термическим разложением его водородных соединений или SiI4:

Дополнительно очищают кремний зонной плавкой. Монокристаллы кремния с соответствующими добавками служат для изготовления различных полупроводниковых устройств (выпрямителей переменного тока, фотоэлементов и пр.). Из кремниевых фотоэлементов (преобразователи световой энергии в электрическую), в частности, построены солнечные батареи, обеспечивающие питание радиоаппаратуры на космических аппаратах.
Кроме полупроводниковой техники кремний широко применяется в металлургии для раскисления сталей и придания им повышенной коррозионной стойкости. Для этих целей используется сплав кремния с железом (ферросилиций), получаемый при совместном восстановлении коксом железной руды и кремнезема. Ферросилиций очень устойчив к действию кислот и потому используется для изготовления кислотоупорных изделий.
Соединения с отрицательной степенью окисления кремния. При окислении металлов кремнием (700—1200 °С) или при нагревании смеси соответствующих оксидов и кремния в инертной атмосфере образуются силициды (но в большинстве случаев валентные соотношения остаются неясными):
2Mn + Si = Mn2Si
6MnO + 5Si = 2Mn3Si + 3SiO2
Силициды применяют для получения жаростойких и кислотоупорных сплавов и в качестве высокотемпературных полупроводниковых материалов. Из дисилицида молибдена МоSi2, выдерживающего нагрев до 1600—1700 °С в агрессивной атмосфере, изготовляют нагреватели электропечей. Ряд силицидов f-элементов применяется в атомной энергетике в качестве поглотителя нейтронов и т. д.
Соединения кремния (IV). Кремний находится в степени окисления +4 в соединениях с галогенами, кислородом и серой, азотом, углеродом, водородом, Рассмотрим некоторые его бинарные соединения: SiНаl4, SiO2, SiS2, Si3N4, SiС, SiН4. Поскольку устойчивое к оординационное ч исло кремния 4, мономерными являются лишь SiНаl4 и SiН4, остальные соединения полимерны. Структурной единицей подавляющего большинства соединений Si (IV) являются тетраэдры из более электроотрицательных атомов (SiO4, SiS4, Si3N4, SiС4) с атомом Si в центре. В плоскостном изображении показаны структуры SiНаl4 и SiS2
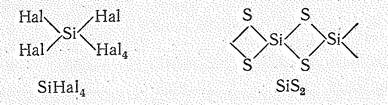
Полимерные соединения с координационной решеткой (SiO2, SiС) характеризуются высокой температурой плавления и химической устойчивостью.
Мономерные соединения, наоборот, легкоплавки, химически активны. Промежуточное положение занимают соединения с цепной структурой (SiS2).
Отвечающие бинарным соединениям анионные комплексы кремния (IV) SiO32-, SiS32-, SiN22- в отличие от таковых углерода (IV) в подавляющем большинстве также полимерны.
Таким образом, имея одинаковое число валентных электронов, углерод и кремний образуют соединения одинакового состава. Однако по строению, а следовательно, и по химической активности однотипные соединения углерода и кремния существенно отличаются.
По химической природе бинарные соединения Si (IV) являются кислотными. Так, большинство из них взаимодействует со щелочами (в растворах и особенно при сплавлении):

и с другими основными соединениями:
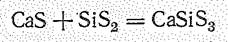
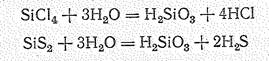 При гидролизе они образуют кислоты:
При гидролизе они образуют кислоты:
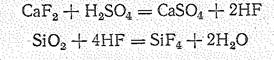 Галогениды SiНаl можно получить непосредственным взаимодействием простых веществ. Тетрафторид обычно получают действием концентрированной серной кислоты на смесь SiO2 + СаF2:
Галогениды SiНаl можно получить непосредственным взаимодействием простых веществ. Тетрафторид обычно получают действием концентрированной серной кислоты на смесь SiO2 + СаF2:
а тетрахлорид при нагревании смеси SiO2 и углерода в атмосфере хлора.
Значительные количества SiF4 получаются как побочный продукт суперфосфатного производства.
В обычных условиях SiF4 — газ, SiСl4 и SiВr4 — жидкости, SiI4 — твердое вещество. Все они бесцветны.
В противоположность тетрагалогенидам углерода тетрагалогениды кремния гидролизуются очень легко. Гидролиз протекает по ассоциативному механизму за счет последовательного присоединения молекул воды и отщепления молекул ННаl, вплоть до образования Si(ОН)4.
Так, гидролиз SiСl4
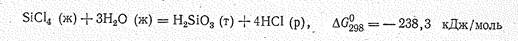
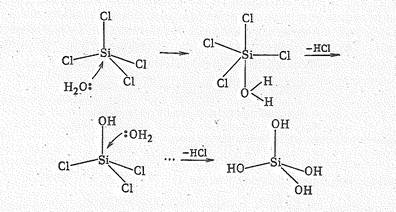 можно представить следующей схемой:
можно представить следующей схемой:
Молекулы Н4SiO4 далее полимеризуются с образованием продукта условного состава Н2SiO3. Вследствие гидролиза тетрагалогениды кремния во влажном воздухе дымят.
Повышение координационного числа кремния (IV) с 4 до 5 в промежуточном соединении можно объяснить возникновением трехцентровой связи. Так, в SiСl4×Н2O три атома хлора связаны с атомом кремния посредством двухцентровьгх связей, а один атом хлора и молекула воды посредством трехцентровой связи.
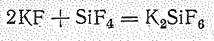 В отличие от других галогенидов Si (IV) кислотная природа SiF4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например:
В отличие от других галогенидов Si (IV) кислотная природа SiF4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например:
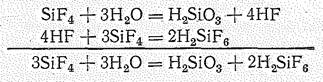 Вследствие устойчивости, гексафторосиликат-иона SiF62- гидролиз SiF4 выражается уравнениями:
Вследствие устойчивости, гексафторосиликат-иона SiF62- гидролиз SiF4 выражается уравнениями:
Гексафторосиликат водорода Н2SiF6 в свободном состоянии не выделен. В водном растворе Н2SiF6 — сильная (типа Н2SО4) гексафторокремневая кислота.
Фторосиликаты металлов получают действием плавиковой кислоты на смесь кремнезема и соответствующего фторида:
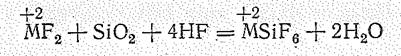
Большинство фторосиликатов растворимо в воде. Малорастворимы производные щелочных металлов (кроме лития) и бария. Наибольшее значение имеет Nа2SiF6. Применяют его для фторирования воды, как инсектицид, в производстве кислотоупорных цементов, эмалей и пр. Тетрафторид кремния и все фторосиликаты ядовиты.
Кроме мономолекулярных выделены гомоцепные фториды и хлориды гомологического ряда SinНаl2n+2, а также некоторые циклические производные. Длина гомоцепи —Si—Si— не превышает 10 атомов (Si10Н22). Гомоцепные олигомеры кремния в противоположность аналогичным соединениям углерода легко разлагаются и химически активны.
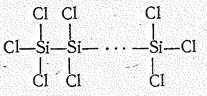
Гомоцепи — Si — Si — обнаруживаются в гидридах кремния (силанах) гомологического ряда SinН2n+2. По составу (SiН4, Si2Н6, Si3Н8, Si4Н10 до Si6Н14) и физическим свойствам силаны сходны с соответствующими углеводородами. В обычных условиях моносилан SiН4 и дисилан Si2Н6 газообразны, трисилан Si3Н8 — жидкость, высшие представители гомологического ряда — твердые вещества.
Поскольку связи Si—Н и Si—Si слабее связей С—Н и С—С, кремневодороды несравненно менее устойчивы и более реакционноспособны, чем соответствующие углеводороды. Большинство из них на воздухе самовоспламеняется. Сгорают силаны с большим выделением тепла, например:
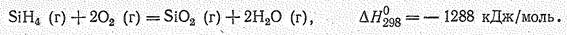
С галогенами силаны взаимодействуют со взрывом. Силаны — кислот- ные гидриды, о чем свидетельствует характер их взаимодействия со щелочами. При этом разложение силанов происходит активно даже в присутствии следов щелочи. В кислой среде кремневодороды довольно устойчивы. С водой реагируют при комнатной температуре:
SiO2 + 3H2O = H2SiO3 (SiO2×xH2O) + 4H2.
С водородом кремний непосредственно не взаимодействует. Силаны получают косвенным путем, например действием кислот на некоторые силициды:
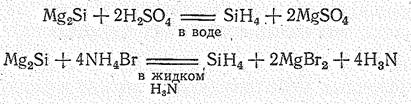
В последнем случае роль кислоты играет NН4Вr. Разложение силицидов кислотами в жидком аммиаке приводит к большему выходу продуктов, чем при разложении в водной среде.
Поскольку связи типа р p— р p для кремния не характерны, гидриды с двойными и тройными связями между атомами кремния — аналоги этилена, ацетилена и бензола неизвестны.
Диоксид кремния SiO2 (кремнезем, кремний) имеет несколько модификаций. В природе он встречается главным образом виде минерала кварца (гексагональная структура), а также кристобалита (кубическая структура) и тридимита (гексагональная структура). Модификации SiO2 отличаются характером расположения кремнекислородных тетраэдров SiO4 в пространстве.
Кремнезем тугоплавок (Тпл.1713 °С, Ткип. 2590 оС), очень тверд и химически стоек. На него действует лишь фтор, плавиковая кислота и газообразный НF, а также растворы щелочей и фосфорная кислота. В воде в обычных условиях SiО2 не растворяется, но начиная со 150 °С его растворимость возрастает, достигая 0,25 % при 500 °С.
Кремнезем легко переходит в стеклообразное состояние. В отличие от кристаллических модификаций SiО2 в кварцевом стекле тетраэдрические структурные единицы SiO4 расположены неупорядоченно. Кварцевое стекло химически и термически весьма стойко. Его применяют для изготовления химической аппаратуры и в оптических приборах.
Аморфный кремнезем является также основой ряда минералов: халцедона, опала, агата и др. Кварцевый песок в огромных количествах используется в производстве стекла, цемента, фарфора и пр.
При сверхвысоком давлении и нагревании (~1,2×I010 Па; ~1300 °С) была получена особая модификация SiО2, названная стишовитом. Его плотность на 60% выше плотности кварца. Это объясняется тем, что стишовит имеет в нем координационное число 6. Благодаря плотной структуре стишовит еще менее активен, чем кварц. Он устойчив даже к концентрированному раствору плавиковой кислоты.
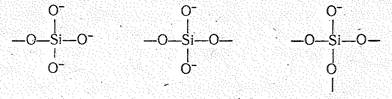 Структурной единицей оксосиликатов, как и SiО2, является тетраэдрическая группировка атомов SiО4. Два соседних кремнекислородных тетраэдра SiО4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiО2 (координационная решетка) каждый SiО4-тетраэдр дает на образование связей Si—О—Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину:
Структурной единицей оксосиликатов, как и SiО2, является тетраэдрическая группировка атомов SiО4. Два соседних кремнекислородных тетраэдра SiО4 соединены друг с другом только через один атом кислорода. Если в кристаллах SiО2 (координационная решетка) каждый SiО4-тетраэдр дает на образование связей Si—О—Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину:
Этим объясняется большое разнообразие возможных способов сочетаний друг с другом SiО4-тетраэдров, структур и типов оксосиликатов. Так, в системе СаО — SiО2 возможны следующие соединения: Са2SiО4, Са3Si2О7, СаSiО3.
При нагревании эквимолярной смеси СаО + SiO2 при 1000 — 1200 °С вначале образуется Са2SiО4, затем Са3Si2О7 и, наконец, СаSiO3.
Тетраэдры SiО4, как и РО4, могут объединяться попарно (Si2О76-), в замкнутые кольца из трех (Si3O96-), четырех (Si4О128-), шести (Si6О1812-) тетраэдров.
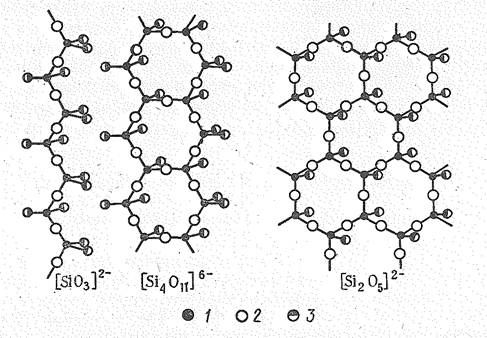
| Рис. 1. Полимерные оксосиликатные ионы: 1 – атом кремния, 2 - мостиковый атом кислорода, 3 – концевой атом кислорода. |
Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки.
Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (асбест), слоистую (слюда) структуру.
Кроме силикатов в природе широко распространены алюмосиликаты, в образовании которых наряду с тетраэдрами SiO4 принимают участие тетраэдры АlO4.
Большинство оксосиликатов нерастворимо в воде. Исключение составляют силикаты s -элементов I группы. Силикаты натрия и калия получают кипячением SiО2 в растворе щелочи. При этом образуется смесь оксосиликатов, которой приписывается общая формула Nа2SiO3 или К2SiО3. Концентрированный раствор силиката натрия, называемый жидким (или растворимым) стеклом, применяется в производстве негорючих тканей, для пропитки древесины, в качестве клея и т. д.
Для оксосиликатов, как и для SiO2, очень характерно стеклообразное состояние. Обычное стекло получают сплавлением смеси соды (или Nа2SО4), известняка и кварцевого песка. При этом образуется стекло приблизительного состава Nа2О×СаО×6SiO2, состоящее из больших полимерных анионов; оно нерастворимо, химически неактивно. Обыкновенное стекло в той или иной степени окрашено в зеленый цвет содержащимися в нем силикатами железа.
Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр.) вводятся соответствующие добавки, изменяющие состав и структуру стекол, Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла, поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. добавление к стеклу соединений кобальта придает им синюю окраску, Сr2О3 — изумрудно-зеленую, соединений марганца фиолетовую окраску и т. д. Существенно изменяются свойства стекол, содержащих В2О3.
Стекло химически очень стойко, но хрупко, что препятствует широкому применению его для изготовления труб и аппаратуры химический производств. В последнее время прочность стекол повышают, придавая им мелкокристаллическую. структуру. В результате управляемой кристаллизации расплавленных стекол удается получить очень мелкокристаллические однородные материалы — ситаллы (стеклокристаллы), прочность которых иногда более чем в 5 раз превышает прочность исходных стекол и приближается к прочности чугуна.
Поскольку SiO2 с водой практически не взаимодействует, кремневые кислоты могут быть получены только косвенным путем: действием кислот на растворы оксосиликатов или гидролизом некоторых соединений Si+4 (галогенидов, сульфида, эфиров ортокремневой кислоты и др.). При гидролизе, например, SiS2 вначале получается ортокремневая кислота Н4SiО4 (К1 = 2×10-10, К2 = 2×10-12):
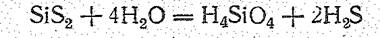
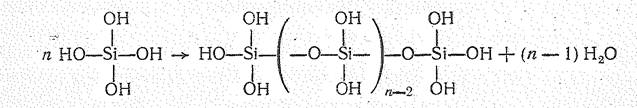 Она растворима в воде, но при стоянии более или менее быстро полимеризуется:
Она растворима в воде, но при стоянии более или менее быстро полимеризуется:
Подобным же образом могут взаимодействовать срединные группы ОH, образуя разветвленные и трехмерные макромолекулы.
Переход ортокремневой кислоты в поликислоты сопровождается превращением молекулярного раствора Н4SiО4 в коллоидные растворы — золи. Золи в свою очередь либо застудневают целиком, т. е. превращаются в гель, либо выпадают в виде объемистых осадков, включающих большое количество воды. Состав получаемых кремневых кислот сильно зависит от исходных веществ и условий проведения реакций.
Нагревая осадки поликремневых кислот, постепенно их обезвоживая, можно получить тонкодисперсный SiO2 — силикагель, который применяется в качестве адсорбента.
Дисульфид кремния SiS2 получают сплавлением аморфного кремния с серой в отсутствие воздуха или по реакции (при 1З00 °С)
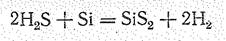
Возогнанный в вакууме дисульфид выделяется в виде белых шелковистых игл (Тпл. 1090 °С, Ткип. 1130 °С). Как показывает рентгеноструктурный анализ, иглы эти слагаются из полимерных цепей, в которых SiS4-тетраэдры объединены ребрами.
SiS2 значительно активнее SiO2. В частности, SiS2 разлагается водой. С основными сульфидами при сплавлении образует сульфидосиликаты (тиосиликаты).
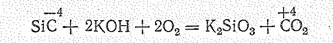 Карбид кремния SiС (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. В чистом виде алмазоподобный SiС — диэлектрик, но с примесями становится полупроводником (DЕ 1,5—3,5 эВ) с n - или р -проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО3 и при сплавлении со щелочами в присутствии окислителя, например:
Карбид кремния SiС (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. В чистом виде алмазоподобный SiС — диэлектрик, но с примесями становится полупроводником (DЕ 1,5—3,5 эВ) с n - или р -проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО3 и при сплавлении со щелочами в присутствии окислителя, например:
Карбид кремния получают в дуговых электропечах (при 2000—2200 °С) из смеси кварцевого песка и кокса. SiС широко применяется как абразивный и огнеупорный материал, его кристаллы используются в радиотехнике.
Большой химической стойкостью и жаропрочностью обладает также нитрид кремния Si3N4. Это твердый тугоплавкий белый порошок (Твозг. ~1900 °С). Он очень устойчив к химическим воздействиям НF, растворов щелочей, металлов. Кристаллы Si3N4 бесцветны, проявляют полупроводниковые свойства (DЕ = 3,9 эВ). Нитрид кремния используют в качестве химически стойкого и огнеупорного материала, в создании коррозионностойких и тугоплавких сплавов, в качестве высокотемпературного полупроводника.
Кроме неорганических соединений кремния большое значение имеют кремнийорганические соединения. Кремнийорганические соединения — представители более широкого класса так называемых элементоорганических соединений. Полимерные элементоорганические соединения сочетают термическую стойкость, присущую неорганическим материалам, с рядом свойств полимерных органических веществ.
По сравнению с ранее рассмотренными элементами 2-го периода у бора наблюдается дальнейшее ослабление признаков неметаллического элемента. В этом отношении он напоминает кремний (диагональное сходство в периодической системе). для бора наиболее характерны соединения, в которых его степень окисления равна +3. Отрицательные степени окисления бора проявляются редко; с металлами бор обычно образует нестехиометрические соединения.
Бор в земной коре (6×10-4 мол. доли, %) находится в виде двух изотопов: 10В (19,57 %) и 11В (80,43 %). Основными его минералами являются бораты: Nа2В4О7×IОН2О — бура, Nа2В4О7×4Н2O - кернит, Н3В3О3 - сассолин.
Относительно невысокое содержание бора в земной коре, не отвечающее его малому порядковому номеру, объясняется легкостью взаимодействия его ядер с нейтронами: 105В + 10n = 42Не + 73Li
Эта способность бора поглощать нейтроны определяет важную роль борсодержащих материалов в ядерной энергетике в качестве замедлителей ядерных процессов и в биологической защите.
 Простые вещества. Бор имеет несколько аллотропических модификаций. Атомы бора в них объединены в группировки В12, имеющие форму икосаэдра-двадцатигранника.
Простые вещества. Бор имеет несколько аллотропических модификаций. Атомы бора в них объединены в группировки В12, имеющие форму икосаэдра-двадцатигранника.
Икосаэдрическая группировка атомов В12
Расположение икосаэдров относительно друг друга в кристалле показано ниже:

Кристаллы бора черного цвета, тугоплавкие (Tпл. 2300 °С, Tкип. 2550 oС), диамагнитны, обладают полупроводниковыми свойствами (DЕ = 1,55 эВ).
В обычных условиях бор (подобно кремнию) весьма инертен и непосредственно взаимодействует только со фтором; при нагревании (400—700 °С) окисляется кислородом, серой, хлором и даже азотом (выше 1200 °С). С водородом бор не взаимодействует. При сильном нагревании восстановительная активность бора проявляется и в отношении таких устойчивых оксидов, как SiO2, Р2O5 и др.:
3SiO2 + 4В = 3Si + 2В2O3
Это объясняется высоким значением энергии Гиббса образования оксида бора В2O3 (DGo298 = –1178 кДж/моль).
На бор действуют лишь горячие концентрированные азотная и серная кислоты, а также царская водка, переводя его в Н3ВО3. Щелочи при отсутствии окислителей на бор не действуют.
 Вследствие высокой энергии Гиббса образования большинства соединений бора его получение в свободном состоянии производится обычно методами металлотермии (чаще всего восстановлением магнием или натрием):
Вследствие высокой энергии Гиббса образования большинства соединений бора его получение в свободном состоянии производится обычно методами металлотермии (чаще всего восстановлением магнием или натрием):
При этом выделяется аморфный бор, который перекристаллизацией в расплавленных металлах можно перевести в кристаллическое состояние. Однако этот метод дает продукт, загрязненный примесями, Более чистый бор (99,5%) получается электролизом расплавленных фтороборатов. Наиболее чистый бор получают термическим разложением паров бромида бора на раскаленной (1000—1200 °С) танталовой проволоке в присутствии водорода:
2 BBr3 + 3H2 = 2B + 6HBr
Или разложением (крекингом) его водородных соединений:
B2H6 = 2B + 3H2
Металлические соединения бора. С металлами бор образует бориды среднего состава М4В, М2В, МВ, М3В4, МВ2, МВ6.
В зависимости от условий один и тот же элемент образует бориды разного состава, например Nb2В, Nb3В2, NВ, Nb3В4, NВ2, Сг4В, Сr2В, СrВ, Сr3В4, СгВ2. По мере увеличения содержания бора структура боридов существенно усложняется. В боридах типа М4В и М2В атомы бора изолированы друг от друга. В боридах типа М3В2 атомы бора связаны попарно, в МВ — в цепи, в М3В4— в сдвоенные цепи, в МВ2 — в сетки из шестичленных колец и, наконец, в боридах состава МВ6 и МВ12 — в трехмерные каркасы соответственно в виде октаэдрических и икосаэдрических группировок атомов.
Большинство боридов d- и f-элементов очень тверды, жаростойки (2000—3000 °С) и химически устойчивы. Бориды s-элементов химически активны, в частности, разлагаются под действием кислот, образуя смеси бороводородов.
Жаропрочные и жаростойкие бориды d-элементов (Сr, Zr, Тi, Nb, Та) и их сплавы применяются для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр. Некоторые бориды используются как катализаторы, в качестве материалов для катодов электронных приборов и т. д.
Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными, чем он сам, элементами, т. е. в галогенидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих анионных борат-комплексах, простейшие из которых приведены ниже:
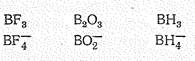
В зависимости от числа s-связей координационное число бора (III) равно 4 или 3, что соответствует sр 3- или sр 2-гибридизации его валентных орбиталей.

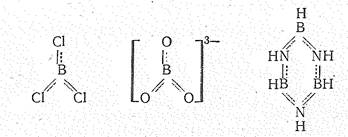 sр 2-Гибридизация валентных орбиталей бора определяет плоское треугольное строение молекул, комплексов и. структурных единиц его соединений. Как и в случае углерода, sр 2-гибридное состояние стабилизируется за счет нелокализованной p р -p р -связи. Последняя образуется при участии свободной 2 р -орбитали атома бора и неподеленной пары электронов связанных с ним атомов:
sр 2-Гибридизация валентных орбиталей бора определяет плоское треугольное строение молекул, комплексов и. структурных единиц его соединений. Как и в случае углерода, sр 2-гибридное состояние стабилизируется за счет нелокализованной p р -p р -связи. Последняя образуется при участии свободной 2 р -орбитали атома бора и неподеленной пары электронов связанных с ним атомов:
В результате возникает частичная двоесвязанность, упрочняется связь и уменьшается межъядерное расстояние.
Так, длина связи d BO при треугольном расположении (0,136 нм) на 0,012 нм короче, чем при тетраэдрическом (0,148 им). Аналогично длина связи d BF в ВF3 (0,129 нм) короче, чем в ВF4- (0,143 нм), а силовая постоянная связи k BF в ВF3 больше (718 Н/м), чем в ВF4- (528 Н/м).
В соответствии с устойчивыми координационными числами бора (III) из бинарных соединений галогениды ВНаl3 мономолекулярны, а оксид В2О3, сульфид B2S3, нитрил ВN — полимерны.
Весьма своеобразна структура гидридов бора.
Бинарные соединения бора (III) кислотные. Об этом, в частности, свидетельствует характер их сольволиза (гидролиза) и взаимодействия с основными соединениями.
Галогениды типа ВНаl3 известны для всех галогенов. Могут быть получены из простых веществ при нагревании. Все они бесцветны. Молекулы ВНаl3 имеют форму плоского треугольника с атомом бора в центре (sр 2-гибридное состояние бора). В обычных условиях ВF3 — газ, ВСl3 и ВВr3 — жидкости, ВI3 — твердое вещество.

В твердом состоянии галогениды имеют молекулярные решетки. В соответствии с увеличением длины связи и уменьшением ее энергии в ряду ВF3 — ВСl3 — ВВr3 — ВI3 устойчивость быстро уменьшается. Об этом свидетельствует также характер изменения энтальпии образования и энергии Гиббса образования. Наибольшее применение имеют ВF3 и ВСl3. Трифторид получают нагреванием В2О3 с СaF2 в присутствии концентрированной Н2SO4 (похоже на получение SiF4).
В2О3 + 3СаF2 + 3Н2SO4 ® 2ВF3 + 3СаSО4 + 3Н2O
Получение трихлорида бора (как и SiСl3) основано на хлорировании раскаленной смеси оксида и угля:
В2O3 + 3С + 3Сl2 = 2ВСl3 + 3СО
Тригалогениды бора — сильные акцепторы электронной пары; ВF3, например, присоединяет молекулу воды, аммиака, эфира, спирта и пр.
При взаимодействии с водой ВF3 дает ВF3×Н2O (Tпл. 10,2 °С, Tразл. 20 °С). С аммиаком образует твердое вещество ВF3×NН3 (Tпл. 163 °С).
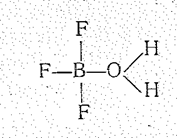
| 
| ВF3×NН3 вещество хорошо растворимое в воде без заметного гидролиза. В продуктах присоединения атомы бора находятся в состоянии sр 3-гибридизации. |
Способность к донорно-акцепторному взаимодействию определяет применение трифторида и трихлорида бора в органическом синтезе в качестве катализаторов.
Кислотная природа тригалогендов бора проявляется, например, при их гидролизе, который протекает необратимо с образованием кислот:
ВHаl3 + 3НОН = Н3ВО3 + 3ННаl
Вследствие этого ВСl3 и ВВr3 во влажном воздухе дымят, взаимодействие ВI3 с водой протекает со взрывом. Кислотный характер ВСl3 проявляет и при взаимодействии с жидким аммиаком:
ВСl3 + 6Н3N = В(NH2)3 + 3NH4Cl
Оксид бора (III) В2O3 существует в виде нескольких модификаций. В кристаллах В2O3 атомы бора находятся внутри равностороннего треугольника ВО3 либо тетраэдра ВО4 из атомов кислорода. Кристаллический В2O3 (плавится при 450 °С и кипит при 2250 °С) имеет высокие значения энтальпии (DНо298 = —1461 кДж/моль) и энергии Гиббса образования (DGo298 = —1178 кДж/моль). Он легко переходит в стеклообразное состояние и очень трудно кристаллизируется, Получают оксид В2О3 обезвоживанием Н3ВО3.
В отличие от цепи Si—О—Si цепь В—О—В относительно легко разрывается при гидратации; в этом отношении кислородные соединения бора (III) сходны с таковыми фосфора. Как кислотный оксид В2O3 энергично взаимодействует с водой с образованием борной кислоты Н3ВO3.
Сульфид бора В2S3 — стеклообразное вещество, водой полностью разлагается,
В соответствии с устойчивыми координационными числами бора 3 и 4 нитрид бора ВN существует в виде двух модификаций. При взаимодействии простых веществ образуется модификация с гексагональной атомно-слоистой структурой типа графита. Гексагональные кольца в нитриде бора содержат чередующиеся атомы В и N (на расстоянии 0,145 нм с углами 120o). Это соответствует sр 2-гибридизации валентных орбиталей атомов бора и азота. (Расстояние между слоями в нитриде бора равно 0,334 им, т. е. короче, чем в графите — 0,340 им.) В отличие от графита ВN - белого цвета («белый графит») полупроводник (DЕ = 4,6—3,6 эВ), легко расслаивается на чешуйки, огнеупорен (Тпл. 3000 °С). Водой разлагается очень медленно при нагревании. Разложение усиливается при действии разбавленных кислот.
В другой модификации нитрида бора ВN (боразон или эльбор) атомы бора и азота находятся в состоянии sр 3-гибридизации. Эта модификация имеет кристаллическую решетку типа алмаза. Она образуется из гексагональной при высоком давлении порядка 6—8 ГПа и нагревании (1800 °С). Превращение гексагонального нитрида бора в боразон аналогично превращению графита в алмаз.
Кристаллы боразона окрашены в цвета от желтого до черного или бесцветны. Боразон очень твердый и в этом отношении почти не уступает алмазу (некоторые образцы боразона даже царапают алмаз). К тому же в отличие от последнего он механически более прочен и термически более стоек. Например, при нагревании в вакууме до 2700 °С боразон совершенно не изменяется, при нагревании на воздухе до 2000 oС лишь слегка окисляется его поверхность, тогда как алмаз сгорает уже при 900 °С. Как и алмаз боразон — диэлектрик. Указанные свойства определяют все возрастающее значение боразона для техники.
Гидриды бора (бораны) по способу получения и по свойствам напоминают силаны. Обычно смесь боранов с водородом получается действием кислот на некоторые химически активные бориды, например:
6МgВ2 + 12НСl = Н2 + В4Н10 + 6МgСl2 + 8В
Простейшее водородное соединение бора BH3 в обычных условиях не существует. Это объясняется его координационной ненасыщенностью и невозможностью образования делокализованной p-связи, которая стабилизировала бы sр 2-гибридное состояние атома бора. Координационное насыщение атома бора возникает при сочетании этих молекул. радикалов друг с другом:
ВH3 (г) + ВН3 (г) = В2Н6 (г), DGo298= — 127 кДж/моль.
Из выделенных в свободном состоянии гидридов бора состава ВnНn+4 и ВnНn+6 простейшими представителями являются: В2Н6, В4Н10 — газы, В5Н9, В6Н10, — жидкости, В10Н14 — твердое вещество.

Для всех боранов DGоf > 0, поэтому их получают косвенным путем.
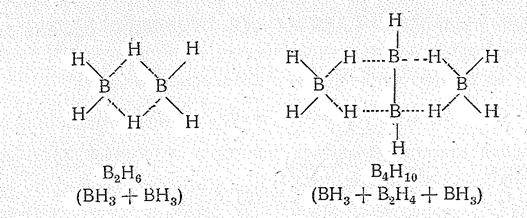
Как нетрудно видеть, бороводороды — соединения с дефицитом электронов. Например, в В2Н6 общее число валентных электронов равно 12; т. е. их не хватает для образования восьми обычных двухэлектронных двухцентровых связей. В диборане В2Н6 имеют место двух- и трехцентровые связи. Две концевые группы ВН2 лежат в одной плоскости, а атомы водорода и бора связаны
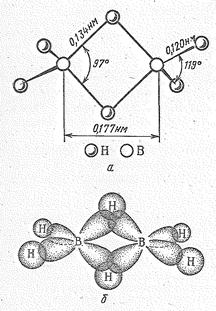
Рис. 1 Строение молекулы (а) и схема перекрывания атомных орбиталей (б) в молекуле В2Н6.
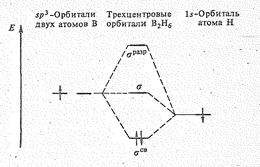
(в) Схема уровней трехцентровых орбиталей диборана В2Н6.
двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровой двухэлектронной связью.
Трехцентровая связь возникает в результате перекрывания двух sр 3-гибридных орбиталей бора (по одной от каждого атома) и 1 s -орбитали атома водорода (Рис. 1 б). Это соответствует образованию связывающей, несвязывающей и разрыхляющей молекулярных орбиталей (рис. 1в). Пара электронов занимает связывающую орбиталь, что обеспечивает устойчивость молекулы В2Н6. Эффективный заряд на мостиковых атомах водорода отрицательный (—0,22), а на атомах бора (+0,22) положительный.
В молекулах других боранов помимо двухцентровых (внешних) связей В—Н и трехцентровых (мостиковых) связей В- - - Н - - - В проявляются также связи В — В. В результате возникают довольно сложные структуры.
Так, в молекуле тетраборана В4Н10 (рис. 2) шесть связей В—Н, четыре трехнентровые связи В- - - Н - - -В и одна связь В—В.
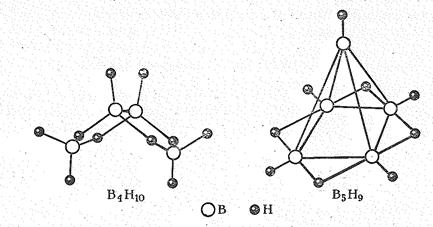 В молекуле пентаборана В5Н9 электроны делокализованы в еще большей степени и образуют пятицентровую связь. В молекуле В5Н9 (рис. 2) из 24 электронов десять используются на образование пяти двухцентровых связей В—Н, восемь—на образование четырех трехцентровых связей В-----Н-----В, а остальные шесть электронов участвуют в построении пятицентровой связи; охватывающей остов из пяти атомов бора. Вследствие делокализации связи координационное число бора в пентаборане достигает шести.
В молекуле пентаборана В5Н9 электроны делокализованы в еще большей степени и образуют пятицентровую связь. В молекуле В5Н9 (рис. 2) из 24 электронов десять используются на образование пяти двухцентровых связей В—Н, восемь—на образование четырех трехцентровых связей В-----Н-----В, а остальные шесть электронов участвуют в построении пятицентровой связи; охватывающей остов из пяти атомов бора. Вследствие делокализации связи координационное число бора в пентаборане достигает шести.
Рис. 2 Структура тетраборана В4Н10 и пентаборана В5Н9.
Структурные формулы простейших боранов приведены ниже (пунктиром обозначены трехцентровые связи):
Бороводороды химически весьма активны (относительно менее активен В10Н14 — декаборан). Так, большинство боранов на воздухе самовоспламеняются и сгорают с выделением очень большого количества тепла (например, для В2Н6 - 2025 кДж/моль, тогда как для С2Н6 = 1425 кДж/моль). Это позволяет использовать их в качестве ракетного топлива.
Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. Наиболее активно гидролизуется диборан:
В2Н6 + 6Н2О = 2Н3ВО3 + 6Н2
Кроме бинарных соединений, получены соединения бора типа В(СlO4)3, ВСl(СlO4)2, ВСl2(СlO4). Первые два — легкоплавкие твердые вещества, а последнее жидкость. Все они малоустойчивы. Во влажном воздухе разрушаются, образуя кислоты:
В(СlO4)3 + 3Н2О = Н3ВО3 + 3НСlO4
Будучи кислотными, бинарные соединения бора (III) при взаимодействии с основными соединениями образуют анионные комплексы, например:
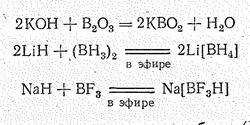
Из анионных комплексов бора(III)—боратов наиболее просты по составу следующие: фтороборат [ВF4]-, фторогидроксобораты [ВF3ОН]-, [ВF2(ОН)2]-, фторогидридобораты [ВF3Н]-, [ВF2Н2]- и гидридоборат [ВН4]-. Все эти комплексы соответствуют sр 3-гибридному состоянию атома бора и имеют тетраэдрическую структуру.
Тетрафторобораты очень разнообразны. По кристаллической структуре и растворимости они очень близки к соответствующим перхлоратам. Относительно мало растворимы К[ВF4], Rb[ВF4] и Сs[ВF4]; соли почти всех остальных металлов хорошо растворимы в воде.
Фтороборат водорода НВF4 не получен. Его водный раствор — сильная кислота.
Получают ее растворением Н3ВО3 в плавиковой кислоте:
Н3ВО3 + 4HF = OH3+ + BF4- + 2Н2О
 Тетрафтороборная кислота образуется наряду с ортоборной кислотой при гидролизе трифторида бора:
Тетрафтороборная кислота образуется наряду с ортоборной кислотой при гидролизе трифторида бора:
Одновременно в незначительном количестве образуются ионы [ВF3ОН]- в [ВF2(ОН)2]- — как продукты частичного гидролиза:

Гидридобораты известны для многих элементов. Тетрагидридобораты щелочных и щелочноземельньх металлов являются преимущественно ионными соединениями, т. е. типичными солями. В твердом состоянии они вполне устойчивы (Тразл. 250—500 °С). В практике чаще всего используется Nа[ВН4] — бесцветная соль, хорошо растворимая в воде. При обычных температурах гидролизуется очень медленно.
Гидридобораты щелочных металлов можно получить взаимодействием соответствующего гидрида с дибораном в эфирном растворе. Для получения Nа[ВН4] обычно используется реакция между гидридом натрия и метиловым эфиром ортоборной кислоты:
4NаН + В(ОСН3)3 = Nа[BН4] + 3СН3ОNа
Тетрагидридобораты других металлов обычно получают обменной реакцией между Nа[ВН4] и соответствующим галогенидом, например:
3Nа[ВН4] + АlСl3 = А1(ВН4)3 + 3NаСl
В противоположность ионным ковалентные тетрагидридобораты типа Аl(ВН4)3 (Tпл. —64,5 °С, Tкип. 44,5 °С), Ве(ВН4)2 (Tвозг. 91 °С) летучи, легкоплавки. В этих гидридоборатах (поскольку имеется дефицит электронов) связь между внешней и внутренней сферами осуществляется за счет трехцентровых связей. Таким образом, эти соединения являются смешанными гидридами. В гидридоборатах же щелочных и щелочноземельных металлов (низкие энергии ионизации) дефицит электронов устраняется за счет перехода электронов атома металла к радикалу ВН4, т. е. в этом случае связь между внешней и внутренней сферами становится преимущественно ионной:

Наибольшее значение имеет Nа[ВН4] — белое кристаллическое вещество. Эта соль вполне устойчива, ее можно перекристаллизовать из водного раствора. В отличие от ионных ковалентные гидридобораты (смешанные гидриды) так же реакционноспособны, как и гидриды бора, например взрывают на воздухе.
Гидридобораты—сильные восстановители. Они широко используются для проведения различных синтезов, применяются как исходные вещества для получения различных гидридов и в особенности диборана:
3NаВН4 + 4ВF3 = 2В2Н6 + 3NаBF4
Эту реакцию, протекающую в эфирной среде, можно рассматривать как реакцию вытеснения одним кислотным соединением (ВF3) другого—(ВН3)2.
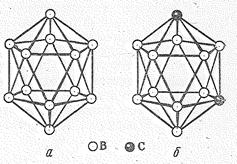
Рис. 3 Структура иона В12Н122- (а) и молекулы В12С2Н12 (б). Атомы водорода не указаны.
Кроме тетрагидридоборатов известны разнообразные гидридобораты более сложного состава и строения.
Известны гидридобораты щелочных металлов, содержащие сложные ионы, например В3Н8-, В11Н14-, В10Н102-, В12Н122-. Последний ион имеет вид икосаэдра с атомами бора в вершинах (рис. 3, а).
Весьма разнообразны также галогенозамещенные гидридоборатные анионы, например, типа [В10Н10-nНаln]2- и [В12Н12-nНаln]2- вплоть до [В10Наl10]2- и [В12Наl12]2- (где Наl = Сl, Br или I).
В последнее время химия бора обогатилась новым классом соединений — так называемыми карборанами (бороуглеродоми). Один из представителей карборанов имеет состав В10С2Н12 (барен). Это кристаллическое вещество (Т. пл. 300 °С), его молекула имеет структуру икосаэдра, в котором атомы углерода аналогичны атомам бора и принимают участие в трехцентровых связях с ближайшими атомами бора (рис. 3, 6). Барен растворим в органических растворителях. Бареновое ядро очень устойчиво по отношению к окислителям, щелочам. Атомы водорода, наоборот, легко замещаются. На основе карборанов получены многочисленные производные, в том числе карборановые полимеры. Многие из них обладают ценными физико-химическими и физико-механическими свойствами (высокая термическая стабильность, механическая прочность, высокие диэлектрические свойства и пр.). Химия карборанов в настоящее время интенсивно изучается.
 Оксоборатные комплексы подобно оксиду бор в большинстве своем полимерны. В качестве простейших представителей можно назвать циклический метаборатный анион (ВО2)33- (в кристаллах КВО2, NаВО2) и полиметаборатный анион (ВО2-)n в виде плоской зигзагообразной бесконечной цепи (в кристаллах Са(ВО2)2, LiВО2):
Оксоборатные комплексы подобно оксиду бор в большинстве своем полимерны. В качестве простейших представителей можно назвать циклический метаборатный анион (ВО2)33- (в кристаллах КВО2, NаВО2) и полиметаборатный анион (ВО2-)n в виде плоской зигзагообразной бесконечной цепи (в кристаллах Са(ВО2)2, LiВО2):
Указанные анионы состоят из плоских треугольных структурных единиц ВО3, что отвечает sp 2-гибридному состоянию атомов бора.
В оксоборатах атомы бора находятся могут также находиться в состоянии sр 3-гибридизации, т. е. образуют четыре s-связи:
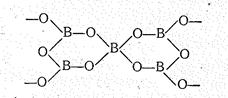
Способы сочетания треугольных ВО3, тетраэдрических ВО4, а также треугольных и тетраэдрических структурных единиц между собой весьма разнообразны. В гидратированных оксоборатах вокруг атомов бора координируются также ОН- группы. Все это объясняет очень большое разнообразие составов и структур оксоборатов. О разнообразии составов безводных оксоборатов можно судить, например, по диаграмме плавкости системы Nа2О-В2O3.
Большинство оксоборатов в воде не растворяется. Исключение составляют бораты s -элементов I группы. Более других используется тетраборат натрия Nа2В4О7.
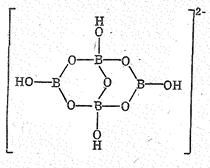 Кристаллы буры Nа2В4O7 ×10Н2O или Nа2[В4O5(ОН)4]×8Н2O состоят из анионов [В4O5(OH)4]2- объединенных в цепи посредством водородных связей.
Кристаллы буры Nа2В4O7 ×10Н2O или Nа2[В4O5(ОН)4]×8Н2O состоят из анионов [В4O5(OH)4]2- объединенных в цепи посредством водородных связей.
Между цепями находятся ионы Nа+ и молекулы Н2О, которые в свою очередь связывают их между собой как за счет электростатических сил, так и через водородные связи.
 Оксобораты водорода — белые кристаллические вещества. Ортоборат водорода (в растворе ортоборная кислота) имеет слоистую решетку, в которой молекулы Н3ВО3 связаны в плоские слои за счет водородных связей, а сами слои соединены друг с другом (на расстоянии 0,318 нм) межмолекулярными силами. Поэтому в твердом состоянии Н3ВО3 — чешуйки, жирные на ощупь. Структура одного слоя кристалла Н3ВО3 показана ниже:
Оксобораты водорода — белые кристаллические вещества. Ортоборат водорода (в растворе ортоборная кислота) имеет слоистую решетку, в которой молекулы Н3ВО3 связаны в плоские слои за счет водородных связей, а сами слои соединены друг с другом (на расстоянии 0,318 нм) межмолекулярными силами. Поэтому в твердом состоянии Н3ВО3 — чешуйки, жирные на ощупь. Структура одного слоя кристалла Н3ВО3 показана ниже:
Оксоборат водорода сравнительно мало растворим в воде. Ортоборная кислота — очень слабая, одноосновная. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН--ионов:

Ортоборную кислоту получают гидролизом галогенидов, боранов и др.