
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривая титрования сильной кислоты сильным основанием
|
|
|
|
Проследим, как изменяется кислотность раствора HCl при титровании его раствором NaOH. Пусть в колбе для титрования находится 20мл 0,1Н раствора HCl, а в бюретке 0,1Н раствора NaOH.
До точки эквивалентности:
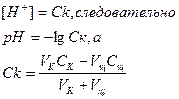
В точке эквивалентности среда нейтральная, pH=7.
После точки эквивалентности:
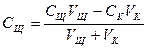 ,
,
рОН=- lgCЩ
рН=14 –рОН.
Построим кривую титрования, откладывая на оси абсцисс объем щелочи, а на оси ординат pH.
б а
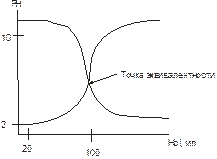
Рисунок 2-Крисые титрования сильной кислоты (а) и сильного основания (б).
Кривая титрования (а) имеет очень резкий скачок pH в точке эквивалентности что позволяет выбирать индикатор, интервал перехода окраски которого лежит около 7 и окраска его изменяется практически от нескольких капель щелочи.
3. 5. 2 Титрование слабых кислот сильными основаниями (или наоборот)
Рассмотрим теперь титрование слабых кислот сильными основаниями. При вычислениях уже нельзя игнорировать, что 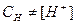 , т.к. кислота не полностью диссоциирует на протоны. Поэтому при вычислениях исходят из величины константы диссоциации слабой кислоты. Кислота диссоциирует согласно уравнения:
, т.к. кислота не полностью диссоциирует на протоны. Поэтому при вычислениях исходят из величины константы диссоциации слабой кислоты. Кислота диссоциирует согласно уравнения:
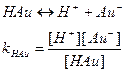
До точки эквивалентности 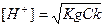
В точке эквивалентности 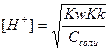 (при титровании слабой кислоты сильным основанием) и
(при титровании слабой кислоты сильным основанием) и 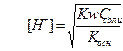 (при титровании слабого основания сильной кислотой).
(при титровании слабого основания сильной кислотой).
После точки эквивалентности 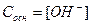 .
.
Согласно сказанному выше, можно предположить, что при титровании одноосновных кислот (HCl, HNO3, CH3COOH и т.п.),и одноосновных оснований кривые титрования отличаются по виду и выглядят следующим образом:
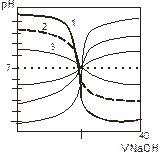
Рисунок 3- Кривые титрования кислот (1. 2, 3) и оснований
Кривые позволяют сделать следующие выводы:
- Точка эквивалентности для слабых кислот и оснований не совпадает с точкой нейтральности. Кривые несимметричнаыотносительно линии нейтрализации.
- Скачок pH на кривых выражен менее резко, чем при титровании сильных кислот и сильных основаниий. Ряд слабых кислот и оснований. у которых Кд
 10-10 вообще не имеютт скачков титрования и в водной среде не титруются.
10-10 вообще не имеютт скачков титрования и в водной среде не титруются.
3. 5. 3 Кривые титрования многоосновных кислот и солей.
Если титровать слабую кислоту слабым основанием, то кривая титрования совсем не будет иметь вертикальной части, т.е в этом случае не будет наблюдаться заметный скачок титрования, поэтому такое титрование никогда не применяют.
Многоосновные кислоты, как известно, диссоциируют последовательно, «по ступенькам». Для сильных кислот такая ступенчатая диссоциация не отражается на характер кривых титрования, они имеют такой же вид, как и для одноосновных кислот. Поэтому кривая титрования H2SO4 имеет одну точку эквивалентности. При титровании слабых многоосновных кислот на кривой возможно несколько точек эквивалентности. Возьмем в качестве примера ортофосфорную кислоту H3PO4, она диссоциирует в три ступени, причем каждой ступени соответствует своя константа диссоциации.
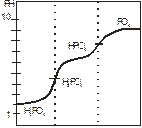
Рисунок 4 – Кривая титрования фосфорной кислоты
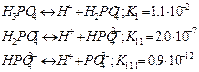
В этом случае имеется как бы смесь трех кислот с тремя различными константами диссоциации и теоретически должно быть три точки эквивалентности. Для каждой ступени диссоциации имеется своя точка эквивалентности. Так, кривая титрования фосфорной кислоты раствором едкой щелочи должна иметь три точки эквивалентности и три соответствующих скачка титрования. Однако на практике все перегибы найти сложно. Можно точно установить только первую точку эквивалентности, вторая плохо заметна, а третья практически отсутствует. Обычно точки эквивалентности соответствующие отдельным ступеням диссоциации многоосновной кислоты, удается установить лишь в том случае, когда коэффициенты диссоциации различаются не менее чем в 106 раз. (Если Кд<10-10, то скачок pH на кривой отсутствует и оттитровать такую кислоту невозможно.)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3275; Нарушение авторских прав?; Мы поможем в написании вашей работы!