
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные индикаторы
|
|
|
|
Лекция 4 Кислотно-основные индикаторы. Титрование в неводных средах. Теория кислоти оснований.
В 1894г Оствальдом была создана, так называемая ионная теория индикаторов. Согласно этой теории кислотно-основные индикаторы – это сложные органические вещества (слабые органические кислоты или основания: HInd или IndOH), способные изменять свою окраску в зависимости от pH раствора. Известно около 200 кислотно-основных индикаторов, относящихся к различным классам органических соединений. Кроме индивидуальных для титрования применяют смешанные индикаторы, представляющие собой смеси 2, 3 и более индикаторов, которые дают более четкие переходы окраски при изменении pH раствора.
В растворах индикаторы могут существовать в молекулярной и ионной формах. Эти формы окрашены в разный цвет и находятся в равновесии, которое зависит от pH среды.
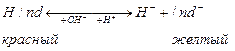
Например, кислотный индикатор метилоранж, в молекулярной форме имеет красную окраску, а в нейтральной и щелочной среде – жёлтую. Изменение кислотности раствора приводит к смещению равновесия диссоциации либо вправо либо влево, что сопровождается изменением окраски раствора.
Предложенная позже хромофорная теория связывает изменение окраски индикаторов с изменением строения индикаторов в результате внутримолекулярной перегруппировки. Свое название эта теория получила из-за того, что окраска органических соединений приписывается наличию в них особых групп, называющихся хромофорами. К хромофорам относятся группы: 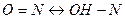 , азогруппа –N=N-, переходящая в группу =N-NH-, группа =С=0. Вызванная хромофорами окраска соединения усиливается присутствием в молекуле соединения групп, называемых ауксохромами. Важнейшими ауксохромами являются группы –OH и –NH2, а также их производные, например –N(CH3)2, -N(C2H5)2 и т.д. Ауксохромы сами по себе не способны придавать окраску соединению, но присутствуя с хромофорами, они усиливают действие последних. Если в результате внутримолекулярной перегруппировки в индикаторе возникают или исчезают хромофорные или ауксохромные группы, влияющие на окраску, то окраска изменяется.Ионная и хромофорная теории не исключают, а дополняют друг друга. Ионизация молекул индикатора обычно приводит к внутримолекулярной перегруппировке и изменению окраски. При изменении pH раствора все ислотно-основные индикаторы изменяют свою окраску не скачкообразно, а плавно, т.е. в определенном интервале значений pH. Этот интервал называется интервалом перехода индикатора
, азогруппа –N=N-, переходящая в группу =N-NH-, группа =С=0. Вызванная хромофорами окраска соединения усиливается присутствием в молекуле соединения групп, называемых ауксохромами. Важнейшими ауксохромами являются группы –OH и –NH2, а также их производные, например –N(CH3)2, -N(C2H5)2 и т.д. Ауксохромы сами по себе не способны придавать окраску соединению, но присутствуя с хромофорами, они усиливают действие последних. Если в результате внутримолекулярной перегруппировки в индикаторе возникают или исчезают хромофорные или ауксохромные группы, влияющие на окраску, то окраска изменяется.Ионная и хромофорная теории не исключают, а дополняют друг друга. Ионизация молекул индикатора обычно приводит к внутримолекулярной перегруппировке и изменению окраски. При изменении pH раствора все ислотно-основные индикаторы изменяют свою окраску не скачкообразно, а плавно, т.е. в определенном интервале значений pH. Этот интервал называется интервалом перехода индикатора  . Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры индикатора. Интервал перехода окраски индикатора характеризуется показателем титрования pT. Показатель титрования – это значение pH, при котором наблюдается наиболее резкое изменение цвета индикатора.
. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей структуры индикатора. Интервал перехода окраски индикатора характеризуется показателем титрования pT. Показатель титрования – это значение pH, при котором наблюдается наиболее резкое изменение цвета индикатора.
Интервал значений pH, в котором происходит изменение окраски индикатора обозначают  :
:
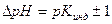 ,
,
где Кинд – константа диссоциации индикатора
Значение К, окраска и 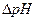 приведены в химических справочниках.
приведены в химических справочниках.
Таблица 1- Окраска индикаторов
| Индикатор | Окраска | pT | 
| |
| В кислотной форме | В основной форме | |||
| фенолфталеин | бесцветная | розовая | 9,0 | 8,2-10 |
| метилоранж | красная | желтая | 3,2 | 3,1-4,4 |
Индикаторы применяют или в виде растворов, или в виде индикаторных бумаг.
4. 2 Теория кислот и оснований
Содержание понятий «кислот» и «основание» в процессе развития химической науки существенно менялось, оставаясь одним из основных вопросов химии. Одной из первых теорий кислот и оснований является теория Аррениуса. Согласно определению Аррениуса-Оствальда кислоты – это вещества, диссоциирующие в воде с образованием иона водорода H+, а основания – вещества, дающие анион гидроксила OH-. По мере накопления данных, развития теории растворов оказалось, что многие вещества, не имеющими в своем составе H+ или OH- обладают свойствами кислот или оснований. Было доказано, что в свободном виде H+ вообще не существует. В водных растворах эти ионы гидратированы, а в неводных сольватированы. Так, например:
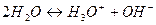
Исследования показали, что некоторые соли в неводных растворителях ведут себя как кислоты или основания. Так например KNH2 в растворе аммиака ведет себя как KOH в воде, т.е. является сильным основанием. Он окрашивает фенолфталеин, обладает электропроводностью, нейтрализует кислоты. Другая соль NH4Cl ведет себя в сухом аммиаке как HCl, т.е. является сильной кислотой. Следовательно, основные и кислотные свойства присущи не только соединениям, имеющим ионы водорода и гидроксильные группы. Поэтому следующей теорией кислот и оснований стала теория сольвосистем.
Согласно этой теории кислотами и основаниями являются химические соединения, образующие катионы и анионы, идентичные катионам и анионам данного растворителя.
Так, например жидкий аммиак диссоциирует:
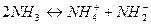
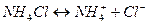 ,
,
значит NH4Cl – кислота (такой же катион)
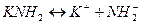 - основание (такой же анион).
- основание (такой же анион).
Недостатком этой теории является то, что в некоторые растворители не диссоциируют ни на катионы ни на анионы, а кислоты и основания в них существуют.
Протолитическая теория Бренстеда-Лоури.
Согласно этой теории кислотами являются химические соединения, способные отдавать протоны другим веществам, а основаниями – вещества, способные присоединять протоны.
Кислотами могут быть и молекулы и катионы и анионы. Например, вода:
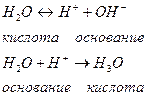
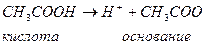
Таким образом, каждая кислота имеет сопряженное основание (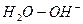 ), а каждое основание имеет сопряженную кислоту.
), а каждое основание имеет сопряженную кислоту.
Сила кислот и оснований зависит от природы растворителя. Так, например, в растворе жидкого аммиака все кислоты полностью диссоциированны т.к. жидкий аммиак проявляет свойства основания. В воде, менее сильном основании, не все кислоты диссоциируют, а лишь только сильные неорганические.
К недостаткам теории Бренстеда-Лоури относится то, что эта теория исключает возможность проявления кислотного характера веществами, не содержащими водород. Поэтому наряду с этой теорией появилась еще одна теория – электронная теория Льюса.
Согласно этой теории основанием является вещество, обладающее неподеленной свободной парой электронов. Например, аммиак является основанием, т.к. его молекула имеет неподеленную электронную пару.
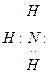
Кислотой является вещество, в молекуле которого не хватает пары электронов до образования устойчивой электронной группировки. Например: BCl3
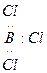
По теории Льюиса вещество не обязательно должно иметь H+ чтобы обладать кислотными свойствами. Так, NH3 и BCl3 взаимодействуют с образованием соли:
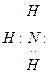 +
+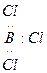 à
à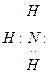
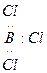
или NH3+HClàNH4Cl
Электронная теория значительно расширила понятие о кислотах и основаниях. Недостатком этой теории является то, что в ней не объясняется тот факт, что одно и то же вещество может быть и кислотой и основанием в зависимости от природы растворителя. В настоящее время на основании исследований ряда ученых было доказано, что одно и то же вещество в зависимости от растворителя, в котором оно растворено, может быть отнесено к кислотам или основаниям.
Современная теория кислот и оснований.
Эта теория дает следующее определение кислотам и основаниям:
«Кислота – это вещество, которое является донором протонов или акцептором электронной пары или дающее такой же катион лиония, как и растворитель, в котором оно растворено. Основание – это вещество, являющееся акцептором протонов, или донором электронной пары, или дающее такой же анион лиата, как и растворитель, в котором оно растворено.
Например соль CH3COONa диссоциирует в уксусной кислоте согласно уравнению:
CH3COONa àCH3COO-+Na+ (основные свойства)
Следовательно, CH3COONa можно количественно оттитровать какой- либо сильной кислотой, например, хлорной:
HClO4+CH3COONaàNaClO4+CH3COOH.
4. 3 Титрование в неводных средах.
Химическая теория растворов Д. И. Менделеева рассматривает растворитель не тольао как среду, в которой протекает реакция, но и как непосредственного участника химиического процесса. Согласно теории неводных сред, разработанной нашими учеными Измайловым и Крешковым одно и то же вещество может вести себя по разному в зависимости от растворителя, т.е. сила кислот и оснований зависит от природы растворителя.
При классификации по донорно-акцепротным свойствам обычно выделяют протонные и апротонные растворители. Притонные могут отдавать или принимать протон и таким образом участвовать в процессе кислотно-основного взаимодействия. Апротонные растворители не проявляют кислотно-основных свойств и не вступают в протолитическое равновесие с растворённым веществом. Протонные растворители принято подразделять на:
1. Амфотерные растворители.Это такие растворители, которые играют роль основания по отношению к кислотам и роль кислот по отношению к основаниям. Эти растворители отличаются способностью и отдавать и присоединять протоны. К ним относятся: H2O, CH3OH, C2H3OH и другие.
2. Кислые растворители. Это вещества кислого характера, молекулы которого могутлишь отдавать протоны. HF, H2SO4, CH3COOH и другие.
3. Основные растворители. Это вещества, обладающие ярко выраженным сродством к протонам (NH3, N2H4).
По влиянию на кислотно-основные свойства растворённого вещества растворители принято делить на нивелирующие и дифференцирующие.
Нивелирующие – это растворители, в которых кислоты и основания раздельной природы не меняют соотношения в своей силе (вода, уксусная кислота и др.)
Дифференцирующи е – растворители, в которых кислоты и основания заметно изменяют соотношение в своей силе (ДМФ, ацетон и др).
К нивелирующим растворителям относятся или очень сильные кислоты или очень сильные основания, например CH3COOH – гидразин. Поскольку это сильные кислоты или основания, все кислоты в их среде становятся одинаковыми по своей силе, то же касается и оснований.
К дифференцирующим же относятся растворы, в среде которых проявляются значительные различия в силе кислот и оснований. Например, ДМФ, ДМСО, пиридин, ацетон. В среде этих растворителей можно раздельно оттитровать не только 2-х, 3-х, но и даже 5 и 6-и компонентные смеси.
Используя влияние неводных растворителей на свойства растворенных электролитов, можно проводить кислотно-основное титрование в неводных средах таких веществ, которые не могут быть оттитрованы в воде. Так, например, многие соли в воде проявляют свойства очень слабых или кислот или оснований и не могут быть оттитрованы непосредственно основаниями или кислотами. В неводных же средах их кислотность или основность повышается настолько, что их можно количественно оттитровать кислотой или основанием.
Титрование в неводных средах получило широкое применение в аналитической химии. Это связано со следующими причинами.
- В неводных средах можно оттитровать те вещества, которые в воде не растворяются.
- В неводных средах можно титровать те вещества, которые в воде не дают резких конечных точек титрований.
- В неводных средах можно проводить не только к/о, но и о/в, комплекснометрическое, осадительное титрование.
Лекция 5 Окислительно-восстановительные методы (редоксиметрия).
- 1 Суть редоксиметрического метода анализа
Этот метод основан на использовании окислительно-восстановительных реакций. В качестве титрантов применяют растворы окислителей или восстановителей. Как правило, окислителями титруют вещества, которые могут окисляться, а восстановителями вещества, которые могут восстанавливаться. С помощью этого метода можно определять и неорганические и органические вещества, способные к окислению или восстановлению.
Существуют несколько способов титрования: прямой и обратный.
В процессе титрования изменяется не рН раствора, а его окислительно-восстановительный потенциал. Если реакцию между окислителем и восстановителем представить в виде:
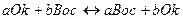 ,
,
то константу равновесия можно представить следующим образом:
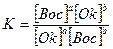 .
.
Воспользовавшись уравнением Нернста, можно выразить концентрации окислителя и восстановителя через потенциалы. После преобразований получим выражение для константы равновесия:
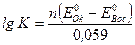 .
.
Таким образом, чем больше разность между стандартными потенциалами окислителя и восстановителя, тем больше константа равновесия. Следовательно, тем более вероятно, что реакция идет до конца.Поэтому для титрования выбирают сильные окислители и сильные восстановители, имеющие высокие значения стандартных потенциалов. К сольным окислителям относятся 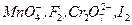 . К сильным восстановителям относятся растворы ионов металлов,
. К сильным восстановителям относятся растворы ионов металлов, 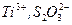 .
.
5. 2 Кривые титрования в редоксиметрии
В процессе титрования меняется Е раствора, поэтому такую зависимость можно выразить графически. Например, рассмотрим, как изменяется потенциал раствора 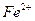 при титровании этих ионов титрантом
при титровании этих ионов титрантом 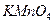 . Запишем реакцию:
. Запишем реакцию:
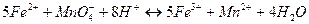 .
.
Согласно уравнению Нернста до точки эквивалентности потенциал раствора рассчитывают по формуле:
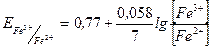 ,
,
после точки эквивалентности:
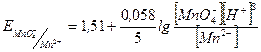 .
.
На рисунке 1 изображена кривая титрованиякривая титрования раствора FeSO4 раствором КМп04.
Кривые окислительно-восстановительного титрования выглядят, в общем, как и кривые титрования кислот и оснований. В близи точки эквивалентности они имеют резкий скачок потенциала. Поэтому для фиксирования точки эквивалентности можно воспользоваться индикаторами, которые меняют свой цвет в зависимости от потенциала системы. В отличие от кривой кислотно-основного титрования скачок не зависит от разбавления и его можно повысить, если один из образующихся ионов связывать в комплекс.
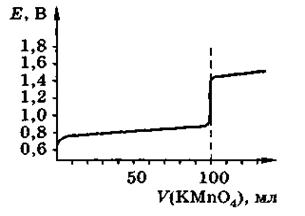
Рисунок 1-Кривая титрования 100,0 см3 0,lMFeSO4 0,1н. раствором КМп04.
5. 3 Индикаторы, применяемые в редоксиметрии
В окислительно-восстановительном титровании точку эквивалентности можно определить тремя способами:
1. При титровании часто можно обойтись вообще без индикаторов. Безиндикаторное титрование возможно в том случае, если титрант или определяемый раствор имеют яркую окраску, как, например, в случае титрования  перманганата калия. Как известно, раствор
перманганата калия. Как известно, раствор 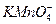 яркого малиново-фиолетового цвета. В результате восстановления
яркого малиново-фиолетового цвета. В результате восстановления 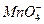 образуются бесцветные ионы
образуются бесцветные ионы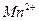 . Без индикатора можно также титровать раствором йода, поскольку
. Без индикатора можно также титровать раствором йода, поскольку 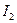 имеет темную окраску, а
имеет темную окраску, а 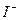 бесцветен.
бесцветен.
2. С помощью индикаторов.
Индикаторы в редоксиметрии можно разделить на две группы:
1) Индикаторы, которые вступают в специфическую реакцию с избытком окислителя или восстановителя. Например ионы 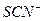 дают ярко-розовый комплекс с
дают ярко-розовый комплекс с 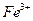 поэтому, если в растворе появится хотя бы одна капля
поэтому, если в растворе появится хотя бы одна капля 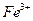 , весь раствор окрашивается в розовый.
, весь раствор окрашивается в розовый.
2) Индикаторы, у которых перемена окраски не зависит от специфических свойств окислителя или восстановителя, а связана с достижением титруемым раствором определенного потенциала. Такие индикаторы называются окислительно-восстановительными. Окисленная и восстановленная формы имеют различную окраску.
Их превращение можно представить следующим образом:
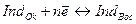 ,
,
где 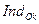 – окисленная форма;
– окисленная форма;
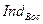 – восстановленная.
– восстановленная.
Применяя к таким индикаторам уравнение Нернста, получим:
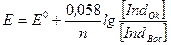 .
.
Таким образом, при изменении потенциала раствора изменяется соотношение между окисленной и в восстановленной формами. Если к окислительно-восстановительной системе прилить 1-2 капли индикатора, то установится соответствующие потенциалу системы соотношение между концентрациями окисленной и восстановленной форм индикатора. При этом раствор приобретает соответственную окраску. Для любой системы можно подобрать такой индикатор, у которого изменение окраски индикатора происходит вблизи точки эквивалентности.
5. 4 Примеры окислительно-восстановительных методов титрования.
5. 4. 1 Перманганатометрия
Перманганатометрией называют метод, в котором рабочим раствором, т.е. титрантом, является раствор перманганата калия 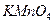 . Определяемыми веществами являются катионы металлов, способные к окислению.
. Определяемыми веществами являются катионы металлов, способные к окислению.
В зависимости от условий, в которых протекает реакция окисления-восстановления анион 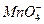 может принимать различное количество электронов:
может принимать различное количество электронов:
| Среда: | Кислая | 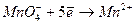
| 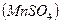
|
| Нейтральная | 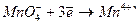
| 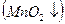
| |
| Щелочная | 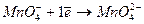
| 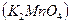
|
В кислой среде окислительно-восстановительный потенциал системы самый большой, поэтому окисление перманганатом калия с аналитическими целями проводят в кислой среде. В связи с этим основное уравнение перманганатометрии имеет вид:
 ;
;
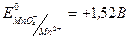 ;
;
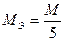 ;
;
Обычно готовят 0,1н. раствор 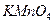 или 0,05н.
или 0,05н. 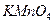 . Перманганат калия, применяемый для приготовления рабочего раствора, как правило, содержит ряд примесей, из которых наиболее значимые примеси
. Перманганат калия, применяемый для приготовления рабочего раствора, как правило, содержит ряд примесей, из которых наиболее значимые примеси 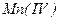 . Кроме того, концентрация перманганата постоянно меняется, т.к. все время идет его восстановление примесями органических веществ, которые находятся в воздухе и дистиллированной воде. Поэтому концентрацию
. Кроме того, концентрация перманганата постоянно меняется, т.к. все время идет его восстановление примесями органических веществ, которые находятся в воздухе и дистиллированной воде. Поэтому концентрацию 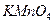 устанавливают по стандартному веществу, концентрация которого точно известна и не меняется. Первичным стандартом в перманганатометрии являются такие вещества как оксалат аммония, натрия или щавелевая кислота:
устанавливают по стандартному веществу, концентрация которого точно известна и не меняется. Первичным стандартом в перманганатометрии являются такие вещества как оксалат аммония, натрия или щавелевая кислота:
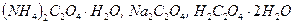 .
.
Взаимодействие щавелевой кислоты с перманганатом калия протекает согласно уравнению:
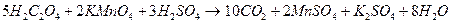 .
.
Разность окислительно-восстановительных потенциалов:
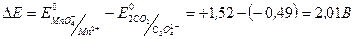 .
.
Большая разность потенциалов показывает, что реакция идет до конца. Однако скорость прямой реакции мала и реакция идет очень медленно. На скорость прямой реакции влияют следующие факторы: рН, температура, катализатор. Поэтому для ускорения реакции повышают рH раствора (в кислой среде E0 имеет максимально значение). Реакцию проводят при нагревании (70-800С). Катализатором этой реакции являются ионы двухвалентного марганца. Они появляются в результате реакции окисления и по мере накопления течение реакции ускоряется до точки мгновенного взаимодействия.
Титрование перманганатом проводят без индикатора, т.к. раствор 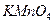 сам имеет малиновую окраску и в точке эквивалентности лишняя капля титранта окрашивает раствор в розовый цвет.
сам имеет малиновую окраску и в точке эквивалентности лишняя капля титранта окрашивает раствор в розовый цвет.
Перманганатометрия используется для определения содержания как восстановителей, так и окислителей. Из окислителей этим методом наиболее часто определяют ионы двухвалентного железа. Соединения двухвалентного железа легко определяются в кислой среде:
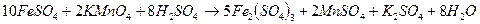 .
.
При окислении ионы двухвалентного железа переходят в ионы трехвалентного железа, поэтому 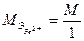 ,
, 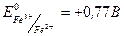 . Реакция идет быстро даже без нагревания, а лучше ее проводить при охлаждении и среде инертного газа для предотвращения окисления ионов железа кислородом воздуха.
. Реакция идет быстро даже без нагревания, а лучше ее проводить при охлаждении и среде инертного газа для предотвращения окисления ионов железа кислородом воздуха.
При анализе сплавов железа, железной руды и минералов, где железо находится как в двухвалентном, так и в трехвалентном виде, предварительно восстанавливают трехвалентное железо в двухвалентное, а затем уже оттитровывают перманганатом. Восстановления трехвалентного железа проводят разными способами: цинком, алюминием и др.
5. 4. 2 Йодометрия
Кроме перманганата, в оксидиметрии в качестве окислителя широко применяют йод:
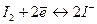 .
.
В этой реакции каждый атом йода присоединяет один электрон, и, следовательно, эквивалент йода равен его атомной массе. Стандартный окислительно-восстановительный потенциал системы 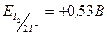 , т.е. немного меньше, чем у системы
, т.е. немного меньше, чем у системы 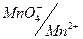 .
.
Вследствие этого йод окисляет гораздо меньшее число восстановителей по сравнению с перманганатом. Реакция окисления йода обратима, и ее направление определяется условиями, в которых она протекает. Наибольший окислительно-восстановительный потенциал этой системы проявляется в нейтральной среде. В щелочных и кислых средах эта реакция протекает по другому механизму. Особенностью йодометрии является тот факт, что в качестве рабочего раствора, т.е. титранта раствор йода используют крайне редко. Раствором 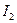 нельзя непосредственно титровать какой-то восстановитель, как это делают в пермангаматометрии. Это связано с тем, что
нельзя непосредственно титровать какой-то восстановитель, как это делают в пермангаматометрии. Это связано с тем, что 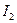 – летучее вещество, которое быстро улетучивается из бюретки, кроме того, он разлагается на свету. Поэтому в йодометрии используют метод обратного титрования. Суть метода заключается в том, что титрантом является не сам
– летучее вещество, которое быстро улетучивается из бюретки, кроме того, он разлагается на свету. Поэтому в йодометрии используют метод обратного титрования. Суть метода заключается в том, что титрантом является не сам 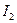 , а раствор первичного стандарта, например тиосульфат Na.
, а раствор первичного стандарта, например тиосульфат Na.
Эта реакция протекает согласно уравнению:
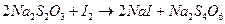 ,
,
при этом ионы окисляются:
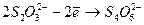 и
и 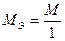 .
.
При титровании в бюретку помещают раствор тиосульфата натрия, а в конические колбы для титрования – определенный объем раствора 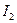 , приготовленный из точной навески.
, приготовленный из точной навески.
Концентрацию тиосульфата можно установить и по другим окислителям, например, по 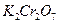 . В качестве индикатора в этом титровании используют водный раствор крахмала. Его использование основано на том, что раствор крахмала окрашивается йодом в темно-синий цвет. В точке эквивалентности синяя окраска раствора исчезает, и раствор становится бесцветным. Йодометрическое титрование используется для определения содержания как окислителей, так и восстановителей, можно использовать как прямую йодометрию так и обратную.
. В качестве индикатора в этом титровании используют водный раствор крахмала. Его использование основано на том, что раствор крахмала окрашивается йодом в темно-синий цвет. В точке эквивалентности синяя окраска раствора исчезает, и раствор становится бесцветным. Йодометрическое титрование используется для определения содержания как окислителей, так и восстановителей, можно использовать как прямую йодометрию так и обратную.
5. 4. 3 Хроматометрия
В качестве окислителей в окислительно-восстановительных методах широко используют раствор дихромата калия. Метод основанный на применении этого окислителя, называется хроматометрией. Дихромат калия отличается от других окислителей очень высокой устойчивостью, поэтому его титр и нормальность не изменяются в течении нескольких месяцев. Готовят раствор дихромата калия по точной навеске химически чистого препарата в мерной колбе, т.е. первичный стандарт в данном случае не требуется. Точку эквивалентности в хроматометрии определяют при помощи индикатора дифениламина, который в точке эквивалентности изменяет свой цвет. Дифениламин является характерным представителем окислительно-восстановительных индикаторов. Хроматометрию наиболее часто применяют для определения ионов 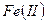 и для определения общего содержания железа в его сплавах, рудах и минералах. Хроматометрия используется для определения других катионов металлов, способных к восстановлению. Кроме того, используя метод обратного титрования, можно с помощью этого метода определять и содержание окислителей в образцах.
и для определения общего содержания железа в его сплавах, рудах и минералах. Хроматометрия используется для определения других катионов металлов, способных к восстановлению. Кроме того, используя метод обратного титрования, можно с помощью этого метода определять и содержание окислителей в образцах.
5. 4. 4 Броматометрия и бромометрия.
В качестве окислителей в редоксиметрии часто применяют или бромат калия 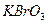 или смесь бромата и бромида (
или смесь бромата и бромида (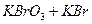 ). Окисление ведут в кислой среде, при этом определяемые ионы окисляются до высшей степени окисления, а бромат и бромид восстанавливаются до
). Окисление ведут в кислой среде, при этом определяемые ионы окисляются до высшей степени окисления, а бромат и бромид восстанавливаются до 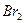 . Выделившийся бром обнаруживают или по появлению желтой окраски раствора или по изменению цвета индикаторов. С помощью бромо- и броматометрии определяют содержание ионов мышьяка, сурьмы, а также фенола, анилина, различных производных бензола, способных к окислению.
. Выделившийся бром обнаруживают или по появлению желтой окраски раствора или по изменению цвета индикаторов. С помощью бромо- и броматометрии определяют содержание ионов мышьяка, сурьмы, а также фенола, анилина, различных производных бензола, способных к окислению.
5. 5. 5 Цериметри
В качестве окислителя могут быть использованы соли 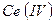 . Это связано с тем, что ионы четырехвалентного церия легко восстанавливаются до
. Это связано с тем, что ионы четырехвалентного церия легко восстанавливаются до 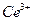 . В результате происходит обесцвечивание желтого раствора соли
. В результате происходит обесцвечивание желтого раствора соли 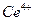 , т.к. соли
, т.к. соли 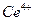 желтые,
желтые, 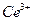 бесцветные. Такое титрование, как и в случае с перманганатом калия, можно проводить без индикатора. Цериметрию можно использовать для тех же случаев, что и перманганатометрию, только эти соли церия отличаются большей устойчивостью.
бесцветные. Такое титрование, как и в случае с перманганатом калия, можно проводить без индикатора. Цериметрию можно использовать для тех же случаев, что и перманганатометрию, только эти соли церия отличаются большей устойчивостью.
Лекция 6 Метод комплексообразования (комплексометрия)
6. 1 Общаяя характеристика метода
Комплексометрия основана на реакциях образования комплексов. В самом общем смысле под комплексом (комплексным соединением) в химии понимают сложную частицу, состоящую из составных частей, способных к автономному существованию. Можно отметить основные признаки, позволяющие выделить комплексные соединения в особый класс химических соединений:
- способность отдельных составных частей к самостоятельному существованию;
- сложность состава;
- частичная диссоциация на составные части в растворе по гетеролитическому механизму;
- наличие положительно заряженной центральной частицы – комплексообразователя (обычно это ион металла), связанной с лигандами;
- наличие определенной устойчивой пространственной геометрии расположения лигандов вокруг комплексообразователя. Примеры:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4876; Нарушение авторских прав?; Мы поможем в написании вашей работы!