
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение урана в водных растворах
|
|
|
|
Вскрытие урановых руд и концентратов
Краткое содержание раздела
Состояние урана в водных растворах.
Кислотное разложение руд и концентратов. Выбор кислоты. Необходимость использования окислителя и его выбор. Выбор способа выщелачивания. Определение оптимальных условий: крупности материала, степени измельчения, концентрации кислоты, отношения Т:Ж, количества окислителя, температуры и продолжительности выщелачивания. Реакции при вскрытии руд и концентратов. Материальные и элементарные балансы процессов. Технологические схемы и аппаратурное оформление агитационного, перколяционного, кучного и подземного методов выщелачивания.
Автоклавный - "бескислотный" процесс вскрытия урановых руд, содержащих сульфиды железа и тяжелых металлов. Условия проведения процесса и результаты.
Щелочное вскрытие окисленных руд. Основы прцоессов содового выщелачивания. Химические реакции. Материальные и элементарные балансы процессов. Примеры технологических схем вскрытия с использованием карбонатов и едкого натрия, их аппаратурное оформление.
Автоклавное выщелачивание урана из неокисленных рудных материалов содовым раствором.
Подземное и бактериальное выщелачивание урана.
Аппаратурное оформление процессов выщелачивания и вскрытия урановых руд.
В водных растворах уран наиболее устойчив в состоянии окисления +6 в виде иона уранила UО2+. В меньшей степени для него характерно состояние U4+, но он может находиться даже в виде U3+. Состояние окисления U(V) может существовать в виде иона UО2+, но все-таки это состояние редко наблюдается из-за склонности к диспропорционированию и гидролизу. Из растворов U3+, U4+ и UО2+ получено большое число твердых соединений.
Трехвалентный уран U3+
Водные растворы U3+ легко получить растворением трихлорида урана в воде. Можно также уран, находящийся в более высоких состояниях окисления, электролитически восстановить на ртутном катоде. За электролизом удобно наблюдать по окраске раствора в свете лампы накаливания: растворы U (IV) окрашены в зеленый цвет, тогда как растворы U(III) - в винно-красный. Из полученного раствора сульфата U(III) можно осадить октагидрат U2(SО4)38H2О путем добавления этанола при перемешивании. При введении щавелевой кислоты или оксалата аммония осаждается соединение розового цвета - оксалат U(III) - U2(C2О4)3×nН2О. Водные растворы U3+ неустойчивы, U (III) реагирует с водой, образуя водород и U4+.
Добавлением сульфатов щелочных металлов или таллия к раствору сульфата U(III) выделены сульфатные комплексы различного состава, например: K2SО4 × U2(SО4)3 × 10H2O.
Четырехвалентный уран U4+
В водных растворах U + частично гидролизуется:
U4+(вод) + ОН-(вод) ® U(ОН)3+(вод)
Изменение свободной энергии этого процесса составляет 76,1кДж/моль.
Присоединение ионов ОН- к U4+ сопровождается большим положительным изменением энтропии системы (217,6 Дж/(моль × К)). Ионы с меньшим зарядом - U(OH)3+ проявляют тенденцию к ориентации молекул воды в значительно меньшей степени, чем ион U4+. Это приводит к повышению степени неупорядоченности в системе и, следовательно, к увеличению энтропии системы.
Многие соли U (IV) выделены в твердом виде из растворов путем осаждения или выпаривания. Большинство солей окрашены в цвета от светло-зеленого до темно-зеленого, за исключением безводного U(C2О4)2 сине-фиолетового цвета.
Из растворимых солей U4+ технологическое значение имеет сульфат. При выделении из водного раствора образуются два гидрата: октагидрат U(SО4)2×8Н2О и тетрагидрат U(SО4)2×4H2О. Октагидрат выделяется из слабокислых, а тетрагидрат - из сильнокислых растворов.
Сульфат U(IV) гидролитически расщепляется водой уже при комнатной температуре с образованием малорастворимого основного сульфата UOSО4×2Н20:
U(SО4)2 + Н2О®UOSО4 + H2SО4
Однако уже в 0,1 н. растворе серной кислоты гидролиз малозаметен. Сильнокислые растворы сульфата U(IV) вполне устойчивы и лишь слегка окисляются кислородом воздуха. Скорость окисления обратно пропорциональна квадрату концентрации водородных ионов. Окислители (хлор, азотная кислота, диоксид марганца) окисляют U(IV) до U(VI).
Сульфат U (IV) - координационно ненасыщенное соединение и может образовывать комплексные соединения 2U(SO4)2•H2SO4•nН2O и U(SО4)2•H2SO4•nH2О. При обработке твердого сульфата плавиковой кислотой сначала происходит растворение осадка с образованием комплекса H2[U(SO4)2F2], а затем при последующем добавлении плавиковой кислоты образуется нерастворимый тетрафторид урана.
В технологической практике используется также образование малорастворимых в кислотной среде соединений четырехвалентного урана: фосфата U(HPO4)2•nН2О (n = 0, 4, 6) и оксалата U(C2O4)2•nН2O (n = 0, 1, 2, 6).
Пятивалентный уран UO2+
Пятивалентное состояние - наименее устойчивое состояние окисления урана в растворе. Установлено, что ион ураноила UО2+ относительно устойчив в узком интервале кислотности при рН ~ 2. В этих условиях UO2+ лишь незначительно диспропорционирует на U4+ и UO22+. Растворы UO2+ миллимолярной концентрации могут быть приготовлены из растворов UO22+ электролитическим восстановлением, восстановлением цинковой амальгамой или водородом, а также растворением UC15 в воде.
Состояние U(V) - промежуточная форма в фотохимических реакциях окисления U(IV), а также при фотохимическом восстановлении U(VI). Фотоактивированные ионы уранила при взаимодействии с сахарозой восстанавливаются до UO2+ с последующим диспропорционированием на U4+ и UO22+.
Изучение гидролитического поведения UO2+ сильно затруднено из-за узкого интервала рН (2,0-4,0), в котором ионы UO2+ достаточно устойчивы. Полагают, что константа кислотной диссоциации UO2+ значительно меньше 10-3. Небольшая степень гидролиза согласуется со свойствами большого положительного иона.
Пока не выделено твердых соединений иона UO2+. Известны только галогениды UO2C1 и UO2Br, полученные в транспортной реакции.
Считают, что образование комплексов типа UF6-, UC16- или UBr6- приводит к стабилизации состояния U(V).
Шестивалентный уран UO22+
Состояние окисления урана +6 наиболее устойчиво в водных раствоpax. U(VI) в водных растворах существует в виде иона уранила UО22+. Структурные данные по твердым соединениям уранила, например NaUO2(CH3COO)3, UO2F2, UO2C12, подтверждают существование иона UО22+ в виде линейной группировки. Рентгеновские исследования уранилиодата показали, что угол О-U-О составляет не 180°, а 176°.
Широко изучен гидролиз уранила. Растворы солей уранила имеют кислую реакцию (раствор 0,02 моль/л соли уранила имеет величину рН 2,9). Известно также, что в водные растворы солей уранила хорошо переходят большие количества триоксида урана. Объяснение этих фактов и резкого повышения электропроводности очень разбавленных растворов по сравнению с другими солями этого типа заключается в предположении существования полимерных частиц UО2(UО3)2+. Образование полимерных форм подтверждено, но считается, что частицы, содержащие более трех атомов урана, имеют небольшое значение, а существование тримера считается доказанным:
UO22+ + H2O = U2O52+ + 2 Н+, К= 1,1 × 10-6
U2O52+ + UO22+ + H2O = U3O82+ + 2 Н+, К= 5 × 10-9
Подтверждено также присутствие отрицательно заряженных полярных частиц [UзО8(ОН)3]- и [U3О8(OH)4]2-.
Начальная стадия внедрения гидроксильных ионов есть продолжение гидролиза:
U3O82+ + H2O = [U3O8(OH)]+ + Н+, К= 2,8 × 10-4.
При изучении зависимости понижения температуры замерзания водного раствора уранилфторида от концентрации сделан вывод, что это соединение, по существу, не ионизовано и проявляет сильную тенденцию к ассоциации. Константа димеризации уранилфторида составляет примерно 1,5.
Растворы солей уранила имеют желтую окраску и флуоресцируют. Это явление широко используется в аналитической практике. Вероятность перехода от одной степени окисления к другой определяется значениями окислительно-восстановительных потенциалов (ОВП).
Реакция U3+ ↔ U4+ + е при температуре 25 °С в 1 моль/л НС1O4 имеет стандартный потенциал, равный -0,631 В, а в 1 моль/л НС1 -0,640 В.
Стандартные потенциалы в 1 моль/л НС1O4 при 25 °С (а) и в щелочном растворе (б):



 а) U -1,8В U3+ -0,631 В U4+ -0,58В UO2+ -0,063 В UO22+
а) U -1,8В U3+ -0,631 В U4+ -0,58В UO2+ -0,063 В UO22+
 -0,32 В
-0,32 В


 б) U 2,17В U(ОН)3 2,12 В U(ОН)4 0,62В UO2(ОН)2
б) U 2,17В U(ОН)3 2,12 В U(ОН)4 0,62В UO2(ОН)2
Различия между ними объясняются слабым комплексообразованием U(IV) с ионами Сl. Потенциал полуреакции
U4+ + 2Н2О = UO22+ + 4Н+ + 2 e
в 1 моль/л НС1 равен -0,334 В. Стандартный потенциал в сернокислой среде сильно сдвигается в отрицательную область (до -0,407 В), что свидетельствует о значительном комплексообразовании U(IV) с сульфат-ионами.
Рассмотрим свойства основных солей уранила, используемых в технологических процессах.
Нитрат уранила. Безводный нитрат уранила получают осторожным нагреванием в вакууме при 165 °С промежуточного продукта UО2(NО3)2•2NО2. Безводный нитрат уранила - светло-желтый кристаллический порошок, при длительном нагревании в вакууме при 170-200 °С UО2(NО3)2 постепенно теряет NО2, темнеет и превращается в красный триоксид урана.
Нитрат уранила образует несколько кристаллогидратов. Гексагидрат UО2(NО3)2•6Н2О - кристаллическое вещество с ромбической решеткой, имеет ярко-желтый цвет с зеленоватым оттенком, плотность 2,742 г/см3. Кристаллизуется гексагидрат из растворов, содержащих менее 30 % HNО3. При t = 59,5 °С гексагидрат плавится, разлагаясь с выделением твердой фазы UО2(NО3)2•ЗН2О и образованием раствора с меньшим содержанием UО2(NО3)2, чем в гексагидрате.
Тригидрат нитрата уранила UО2(NО3)2•ЗН2О кристаллизуется из растворов с концентрацией азотной кислоты 32-53 %. Он представляет собой кристаллы триклинной сингонии лимонно-желтого цвета плотностью 2,93 г/см3.
Дигидрат UО2(NО3)2•2Н2О получается при упаривании и охлаждении водных растворов с содержанием более 54 % HN03. Дигидрат  образует кристаллы моноклинной сингонии лимонно-желтого цвета плотностью 3,35 г/см.
образует кристаллы моноклинной сингонии лимонно-желтого цвета плотностью 3,35 г/см.
Все кристаллогидраты нитрата уранила хорошо растворяются в воде (56 % по нитрату уранила). Растворимость нитрата уранила падает с увеличением концентрации азотной кислоты и нитратов.
Нитрат уранила легко растворим в эфирах, спиртах, альдегидах, кетонах и нерастворим в бензоле, толуоле, четыреххлористом углероде. Растворимость уранилнитрата в некоторых органических соединениях сравнима с его растворимостью в воде, что делает возможным экстракционное выделение урана из водных растворов. При этом в органическую фазу переходят гидраты уранилнитрата с содержанием от двух до четырех молекул воды (например, UО2(NО3)2•(С2Н5)2О•ЗН2О.
Уранилнитрат образует сольватные комплексы с нейтральными фосфороорганическими соединениями: алкилфосфатами, алкилфосфонатами, алкилфосфинатами и фосфиноксидами. Наибольшее промышленное применение из них имеет комплекс уранилнитрата с трибутилфосфатом (ТБФ) UО2(NО3)2•2ТБФ.
Сульфат уранила. Кроме безводного сульфата уранила известно девять кристаллогидратов с содержанием воды от 0,5 до 4 молекул на 1 молекулу сульфата уранила. Наиболее устойчивыми гидратами являются моногидрат и тригидрат.
Тригидрат сульфата уранила кристаллизуется из водных или слабокислых растворов сульфата уранила (при концентрации H2SО4 < 30 %). Тригидрат представляет собой желто-зеленые кристаллы ромбической сингонии с теоретической плотностью 3,88 г/см3.
Моногидрат кристаллизуется из сильнокислых растворов уранилсульфата (при концентрации H2SО4 = 30 - 45 %). Сульфат уранила хорошо растворим в воде, его растворимость уменьшается с ростом концентрации серной кислоты (рис. 1.3).
Безводный сульфат уранила получают дегидратацией кристаллогидратов при t = 300 °С. Он имеет две кристаллические модификации: α-U02S04 (ромбической сингонии) и β-UО2SО4 (моноклинной сингонии) плотностью 5,0 и 5,24 г/см3 соответственно.
Известны кислые и основные сульфаты уранила:
2UО2SО4 • H2SО4 • 5H2О,
2UО2SО4 • H2SО4 • 2H2О,
2UО2SО4 • UО2(OH)2 • 8H2О.
В природе встречаются сульфатные минералы:
· циппелит (UО2)2SО4(OH)2 • 4Н2О,
· уранопилит (UO2)6SO4(OH)10 • 12Н2О,
· иоганнит Cu(UО2)2(SО4)2(OH)2 • 6Н2О.
Уранил в сульфатных средах склонен к образованию комплексных соединений. В слабокислых растворах при рН 1 - 2 образуются дисульфатные и трисульфатные комплексные анионы [UО2(SО4)2]2- и [UО2(SО4)3]4-, которые хорошо извлекаются анионитами и экстрагируются аминами. Изучены комплексные сульфаты аммония, калия, лития, рубидия, цезия и магния.
При обработке раствора нитрата уранила олеумом образуются желтые кристаллики персульфата уранила UО2S2О7.
Если тиосульфат натрия обработать раствором нитрата уранила, в осадок выделится тиосульфат уранила UО2S2О3.
Сульфат уранила обладает высокой термической стойкостью, разлагаясь на триоксид урана и серный ангидрид лишь при температуре темно-красного каления, сульфаты алюминия, железа и некоторых других примесей разлагаются на оксиды и серный ангидрид при более низкой температуре (500 - 600 °С), что позволяет регенерировать часть серной кислоты после сульфатизации.
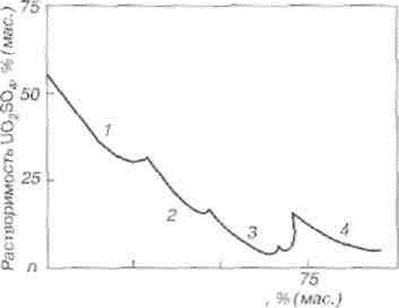
Влияние концентрации серной кислоты на растворимость сульфата уранила (25 °С). Состав донной фазы: 1 - UО2SО4 • ЗН2О; 2 - UО2SО4 • Н2О; 3 - 2UО2SО4 • H2SО4 • 5Н2О; 4 - UО2SО4 • H2SО4 • 0,5H2O
Фторид уранила. При растворении триоксида урана в плавиковой кислоте получается раствор уранилфторида, из которого, испаряя воду, можно получить кристаллогидрат UО2F2 • nН2О. Безводный уранилфторид получается при действии на триоксид урана газообразным фтороводородом при 300 - 500 °С. Теоретическая плотность UO2F2 составляет 6,37 г/см3, насыпная плотность - 2,55 - 2,95 г/см3.
Уранил фторид легко растворим в спирте и ацетоне, хорошо растворим в воде (растворимость при 25 °С - 65,6 % (маc.)), но нерастворим в эфире и в изоамиловом спирте. Растворимость уранилфторида резко уменьшается с увеличением концентрации плавиковой кислоты. При концентрациях HF 11,9; 20,7 и 32,5 % (мас.) растворимость UО2F2 составляет соответственно 31,9; 23 и 1,4 % (мас).
При растворении уранилфторида в плавиковой кислоте образуются фторидные комплексы типа UО2Fn2-n, где п изменяется от 1 до 3. Константа образования иона UO2F+ из U02+2 и F- составляет 3,9 • 104, иона U02F42- - 3,1 • 1010.
Для уранилфторида характерны реакции восстановления. При прокаливании на воздухе уранилфторид превращается в закись-окись урана, а в вакууме при повышенной температуре - в диоксид, закись-окись и тетрафторид урана. Восстановление уранилфторида водородом протекает с заметной скоростью при 500 - 700 °С:
UO2F2 + H2 → UO2 + 2 HF (500 оС)
2 UO2F2 + 2Н2 → UO2 + UF4 + 2 Н2О (700 оС)
Карбонаты уранила. При карбонатном выщелачивании урановых руд получаются уранилтрикарбонатные комплексы натрия и аммония Na4[UO2(CO3)3] и (NH4)4[UO2(CO3)3].
При термическом разложении аммонийуранилтрикарбоната совместно с уранатом и диуранатом выделяется карбонат уранила UO2CO3 - кристаллическое вещество светло-желтого цвета плотностью 5,24 г/см3. Минеральными кислотами он разлагается с образованием соответствующей соли уранила и выделением углекислоты, со щелочами образует полиуранаты. Полное термическое разложение UO2CO3 на оксиды наступает при 515 °С. Гидратированный карбонат уранила получают из концентрированных растворов нитрата уранила под давлением СO2 при 140 °С.
Комплексные уранилкарбонаты щелочных металлов и аммония образуются при взаимодействии соответствующих карбонатов и бикарбонатов с гидроксидом уранила, полиуранатами и растворимыми солями уранила, например:
UO2(OH)2 + 4 NaHCO3 = Na4[UO2(CO3)3] + СO2 + З Н2O.
При избытке карбонат-ионов в содовой среде образуется натрий уранилтрикарбонат, являющийся наиболее стабильным соединением из уранилкарбонатов.
Карбонатный комплексный анион обладает большой прочностью. Константа образования [UO2(СO3)3]4-из UO22+ и СO32- составляет 2 • 1018. В водных растворах трикарбонатный комплексный анион частично гидролизуется, при разбавлении растворов до концентрации 0,001 моль/л заметное количество урана осаждается в виде полиуранатов. Растворимость натрийуранилтрикарбоната уменьшается с возрастанием ионной силы раствора, а также с повышением температуры.
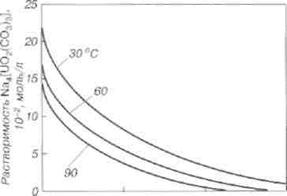 1 2 3
Общая концентрация солей, моль/л
1 2 3
Общая концентрация солей, моль/л
| Влияние температуры и солевого состава водных растворов на растворимость натриевого трикарбоната уранила |
При насыщении растворов уранила углекислотой можно получить дикарбонатный комплекс Na2[UО2(CО3)2(H2О)2].
Он отличается большой растворимостью (1415 г/л при 18 °С). Натрийуранилтрикарбонат - желтый кристаллический продукт, выделяющийся без кристаллизационной воды.
При нагревании до 400 °С он разлагается на уранат натрия и соду. В сильнощелочных средах (рН > 13) Na4[UО2(CО3)3] разрушается с образованием полиураната натрия. При действии кислот (в зависимости от конечного значения рН) образуется раствор соли уранила или осадок полиуранатов. К нагреванию растворы натрийуранилтрикарбоната устойчивы (начинающийся в первые моменты гидролиз быстро прекращается благодаря выделяющемуся бикарбонату натрия):
2 Na4[UO2(CO3)3] + 3 H2O = Na2U2O7 + 6 NaHCO3.
При концентрации карбоната 3-5 % равновесие сдвинуто практически нацело в сторону образования натрийуранилтрикарбоната. Шестивалентный уран в содовых растворах может быть восстановлен до четырехвалентного такими восстановителями, как дитионат натрия, цинк, амальгама натрия, водород под давлением, а также электролизом, при этом образуется осадок гидратированного диоксида урана
Большой интерес представляет аммонийуранилтрикарбонат. Он довольно хорошо растворим в воде, при большом избытке карбоната аммония из раствора можно выделить аммонийуранилтрикарбонат в виде кристаллов моноклинной системы с плотностью 2,77 г/см3, этикристаллы оптически двуосны.
Значения растворимости АУТК в водных растворах карбоната аммония приведены в таблице:
Растворимость уранилтрикарбоната аммония в зависимости от содержания (NH4)2CO3 при различных температурах
| Температура, оС | Концентрация карбоната аммония, % мас. | ||||||
| 104,6 | 80,3 | 53,2 | 22.6 | 5,8 | 1.7 | 0,4 | |
| 119,3 | 94,7 | 65,7 | 30,5 | 8,2 | 2,7 | 0,5 |
В отличие от натриевого комплекса с повышением температуры растворимость аммонийного комплекса увеличивается. Растворимость аммонийуранилтрикарбоната резко уменьшается по мере увеличения концентрации карбоната аммония в растворе.
Кислота и щелочь разрушают аммонийуранилтрикарбонат с образованием растворов уранила и осадка полиураната соответственно. Комплекс устойчив в тех же пределах рН, что и натриевый трикарбонат уранила.
Кипячение водных растворов аммонийуранилтрикарбоната приводит к быстрому его разрушению с получением осадка урана сложного состава. Этот осадок неустойчив к нагреванию: при 300 - 500 °С он разлагается с образованием триоксида урана, аммиака, углекислоты и воды. Прокаливание кристаллов при более высокой температуре (700 - 800 °С) без доступа воздуха приводит к образованию диоксида урана.
Оксалат уранила. При действии щавелевой кислоты на растворы солей уранила осаждается UО2C2О4•ЗН20 - тригидрат оксалата уранила, представляющий кристаллы моноклинной сингонии желто-зеленого цвета с теоретической плотностью 3,07 г/см3. Растворимость тригидрата в воде при 15 °С - 0,47, при 100 °С - 3,06 % (масс.).
Известны также гидраты оксалата уранила с одной и двумя молекулами кристаллизационной воды. Безводный оксалат уранила получают дегидратацией гидратов при 110 °С.
Оксалат уранила легко растворяется в растворах щавелевой кислоты и оксалатов щелочных металлов и аммония с образованием комплексных соединений H2[UО2(C2О4)2], (NH4)4[UО2(C2О4)3]•nН2O, Na2[UO2(C2O4)4•(H2O)2], Na6[UO2(C2O4)4(H2O)2]•4Н2O и др.
Известны также смешанные комплексы:
карбонатно-оксалатные:
Na2[UO2(CO3)(C2O4)H2O], (NH4)4[(UO2)2(CO3)3(C2O4)(H2O)4];
оксалатно-сульфатные:
K2[UO2(C2O4)(SO4)(H2O)2] • H2O, Pb[UO2(C2O4)(SO4)(H2O)2],
Cs2[UO2(C2O4)(SO4)(H2O)2], (NH4)4[UO2(C2O4)(SO4)2];
оксалатно-роданидные:
K2[UO2(C2O4)(CNS)(OH)(H20)2].
Можно отметить также малорастворимую комплексную соль триацетатов натрия и уранила NaUO2(CH3COO)3, которая применялась для отделения урана и плутония от продуктов деления.
Ион уранила образует растворимые комплексы со многими органическими соединениями: яблочной, лимонной, янтарной, гумусовыми кислотами и др. Образование этих комплексов увеличивает миграционную способность урана в геохимических процессах
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4162; Нарушение авторских прав?; Мы поможем в написании вашей работы!