
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения состава растворов
|
|
|
|
ЛЕКЦИЯ № 2
РАСТВОРЫ
1. Классификация систем, состоящих из двух и более веществ
Системы, состоящие из двух и более веществ, в зависимости от размеров частиц можно разделить на: дисперсные системы(10–3 ÷ 10–5 см), коллоидные растворы(10–5 ÷ 10–7 см) и истинные растворы(менее 10–7 см).
Дисперсная система – это система из двух или более веществ, в которой одно или несколько веществ измельчено и равномерно распределено в другом.
Дисперсные системы термодинамически неустойчивы и с течением времени разделяются.
Коллоидный раствор – это система,характеризующаяся такой степенью раздробленности компонентов при которой броуновское движение препятствует осаждению частиц.
Коллоиды по внешнему виду напоминают истинные растворы.
Коллоиды находятся в метастабильном состоянии и достаточно небольшого внешнего воздействия, чтобы началась коагуляция и разделение компонентов коллоидного раствора.
Истинный раствор – это система в которой растворённое вещество и растворитель измельчены до атомного или молекулярного уровня и равномерно распределены по всему объему раствора. Истинные растворы – термодинамически устойчивые системы. В последующем вместо названия истинный раствор будет применяться термин «раствор». Раствор – это однородная система, состоящая из двух или более компонентов.
| Массовая доля (ω) –отношение массы растворенного вещества к массе раствора: ω(x) = m(x) ∕ m(раствора). 2.1 |
Массовая доля выражается в долях от единицы или в процентах (в долях от ста). Процентная концентрация показывает, сколько граммов растворённого вещества содержится в 100 г раствора. Например: ω(Н2SО4) = 3% или 3% Н2SО4, т.е. в 100 г раствора содержится 3 г Н2SО4.
Молярная концентрация (С) – отношение количества молей растворенного вещества к объему раствора: С = n ∕ V 2.2
Сокращенное обозначение молярной концентрации – М. На практике молярную концентрацию выражают обычно в моль/л. Например,
С(Н2SО4) = 2 моль/л или 2 М Н2SО4, т.е. в одном литре раствора содержится 2 моль Н2SО4.
На практике также применяются мольная доля, моляльная, нормальная и другие концентрации.
3. Растворы неэлектролитов
Неэлектролиты – вещества растворы которых не проводят электрический ток.
3. 1. Законы Рауля
Плавление, кипение и другие фазовые переходы для летучего вещества протекают при определенных значениях давлений паров над веществом. При переходе от чистого растворителя к раствору давление пара растворителя надраствором изменяется, что соответственно приводит к изменению температур кипения и замерзания растворов, а также осмотического давления.
Рассмотрим двухкомпонентный раствор:
растворитель – летучее вещество, это вещество которое можно перевести в газообразное состояние при атмосферном давлении,
растворенное вещество – нелетучее и не диссоциирующее на ионы (неэлектролит) вещество.
Количественно равновесное состояние между жидкостью и паром характеризуется давлением насыщенного пара. Обозначим:
р0 – давление насыщенного пара над чистым растворителем,
р – давление насыщенного пара над раствором.
Молекулы нелетучего компонента препятствуют улетучиванию из раствора молекул растворителя (какая-то часть поверхности просто занята ими), т.е. р0> р. Таким образом, давление насыщенного пара растворителя над раствором ниже, чем над чистым растворителем. Отсюда:
(р0 – р) – абсолютное значение понижения давления пара растворителя над раствором,
(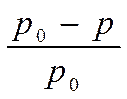 ) – относительное понижение давления пара растворителя над раствором.
) – относительное понижение давления пара растворителя над раствором.
В 1887г французский ученый Ф.М.Рауль открыл закон, согласно которому относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
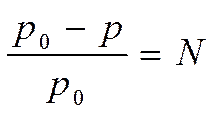 2.3 2.3
| (3.8) |
Из закона Рауля следует, что понижение давления пара над раствором не зависит от природы растворенного вещества, а зависит только от количества частиц растворенного вещества.
Уменьшение давления пара над раствором приводит соответственно к повышению температуры кипения и понижению температуры замерзания раствора. Практическим применением закона Рауля стали, выведенные на его основе, криоскопический и эбуллиоскопический законы. Данные законы позволяют рассчитать повышение температуры кипения и понижение температуры замерзания растворов нелетучих неэлектролитов.
Температура кипения – это температура при которой давление пара над раствором становится равным внешнему давлению. Для достижения раствором данного давления пара растворителя требуется более высокая температура в сравнении с чистым растворителем.
Температура замерзания – это температура при которой давление пара над раствором станет равным давлению насыщенного пара над кристаллами растворителя. Для раствора, в сравнение с чистым растворителем, температура замерзания ниже.
Криоскопический и эбуллиоскопический законы Рауля имеют вид:
| ΔТзам. = К·Сm –криоскопический закон, | (2.4) |
| ΔТкип. = Э·Сm – эбуллиоскопический закон | (2.5) |
где ΔТзам. – понижение температуры замерзания,
К – криоскопическая постоянная растворителя,
ΔТкип. – повышение температуры кипения,
Э – эбулиоскопическая постоянная растворителя,
Сm — моляльная концентрация растворенного вещества.
Значения криоскопических и эбулиоскопических констант для воды и бензола приведены в таблице 1.
Таблица 1 – Криоскопические и эбулиоскопические константы
| Растворитель | ТКИП, °С | Э, град·моль-1·кг | ТЗАМ, °С | К, град·моль-1·кг |
| Вода – Н2О | 0,52 | 1,86 | ||
| Бензол – С6Н6 | 80,1 | 2,53 | 5,5 | 5,12 |
Физический смысл криоскопических и эбулиоскопических констант следующий. Они показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномоляльный раствор (содержащий I моль растворенного вещества на 1кграстворителя) по сравнению с температурами кипения и замерзания чистого растворителя.
Криоскопическая и эбулиоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя.
Законы Рауля широко применяются на практике. Например, 58 % (по массе) водный раствор этиленгликоля замерзает при температуре -50 °С.
4. Растворы электролитов
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!