
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз расплавов и водных растворов
|
|
|
|
Разберем данный вопрос на следующих примерах:
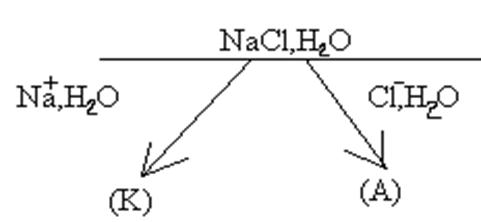
1) Электролиза расплава NaCl с инертными электродами. 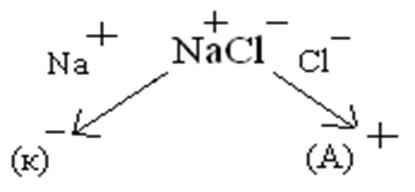
К) Na +  + e = Naо, А) 2Сl-- 2e = Сl2.
+ e = Naо, А) 2Сl-- 2e = Сl2.
На катоде идет процесс восстановления, а на аноде – окисления.
При электролизе данного соединения получается металлический натрий и свободный хлор.
2) Химизм промышленного получение алюминия.
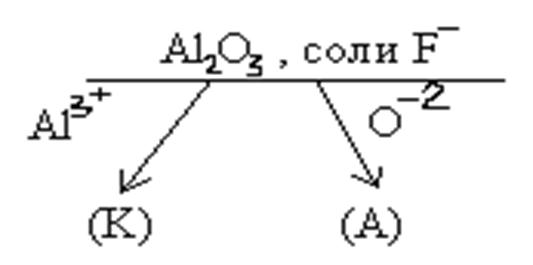
К) Аl3++ 3e = Аl , А) 2О2–- 4e = О2.
, А) 2О2–- 4e = О2.
В случае водных растворов наблюдается конкуренция между ионами растворенного вещества и воды за процесс окисления и восстановления. При этом следует учитывать, что металл анода тоже может окисляться – растворимый анод. К нерастворимым анодам относятся: углерод, золото, платина, свинец в растворе серной кислоты и др.
Последовательность разрядки водных растворов ионов в ходе электролиза согласуется со следующей схемой:
1) Катионы:
– от лития до Аl не восстанавливаются, так как идет электролиз воды;
– от Мn до водорода – наряду с восстановлением металла идет восстановление воды;
– металлы после водорода – идет восстановление металла.
2) Анионы:
– если анод растворимый – вначале происходит окисление анода;
– если анод нерастворимый – вначале окисляются анионы бескислородных кислот (I–, Вr–, Cl–) за исключением F–;
– далее идет окисление ОН– и Н2О;
– затем окисляются анионы кислородсодержащих кислот и F-.
Разберем различные случаи электролиза водных растворов:
1) Электролиз водного раствора NaCl с инертными электродами.
К) 2Н2О + 2e = Н2 + 2ОН , А) 2Сl
, А) 2Сl - 2e = Сl2.
- 2e = Сl2.
Вторичная реакция в ходе электролиза Na ОН
ОН = NaОН.
= NaОН.
Таким образом в ходе электролиза водного раствора NaОН с инертными электродами образуются: Н2, Сl2 и NaОН.
2) Электролиз водного раствора сульфата натрия с инертными электродами.

К) 2Н2О + 2e = Н2 + 2ОН , А) 2Н2О - 4e = О2 + 4Н+.
, А) 2Н2О - 4e = О2 + 4Н+.
Вторичная реакция – Н+ + ОН = Н2О.
= Н2О.
В ходе электролиза идет разложение воды с образованием О2 и Н2. Сульфат натрия не расходуется в ходе электролиза, но он обеспечивает высокую электропроводность электролита.
3) Электролиз сульфата меди с медным анодом.
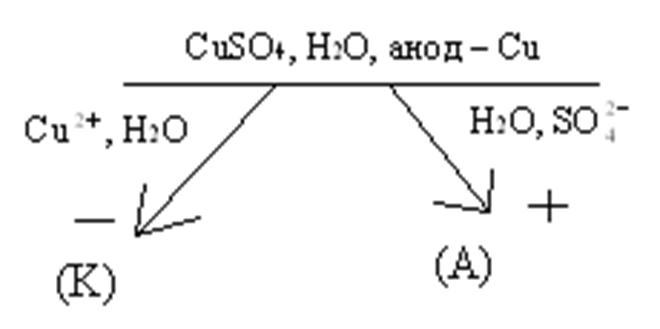
К) Сu2++ 2e = Сu0, А) Сu0 - 2e = Сu2+.
Из приведенной схемы видно, что в данном случае происходит перенос меди с анода на катод, что приводит к очистке меди. Примеси, входящие в состав черновой меди, включают в себя неактивные металлы (Аg, Аu, Рt) и активные металлы (Fe, Мn и др.). Неактивные металлы будут образовывать осадок в электролизёре, а в растворе будут накапливаться катионы активных металлов. Поэтому периодически производится замена электролита.
2.2. Количественные расчёты в электролизе
Применительно к электролизу закон эквивалентов можно сформулировать следующим образом: количества моль эквивалентов веществ, образующихся на катоде и аноде, равны числу моль эквивалентов электронов прошедших через раствор электролита. Применяемые в расчетах законы Фарадея – это частный случай применения закона эквивалентов к электрохимическим реакциям.
Объединенный закон Фарадея имеет вид:
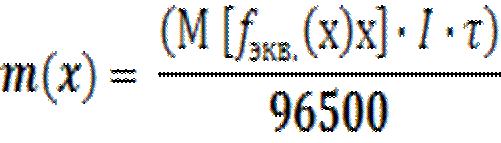
| (4.2) |
где m(х) – масса окисленного или восстановленного вещества при электролизе в граммах;
 – молярная масса эквивалента этого вещества;
– молярная масса эквивалента этого вещества;
I – сила тока (в амперах);
τ – время электролиза (в секундах);
F – число Фарадея равное 96500 Кл.
Если в реакции окисляются или восстанавливаются газообразные вещества, то в полученное уравнение вместо масс подставляются соответствующие значения объемов.
Пример:
Рассчитать массу меди, которая должна выделится на катоде при электролизе раствора сульфата меди в течение 2 часов при силе тока в 100 А.
Решение: К) Сu2+ + 2e®Cu,fэкв.(Cu) = ½, М(½Cu) = 31,773 г ∕ моль.
Подставляя в уравнение закона Фарадея соответствующие значения получаем: m(Cu)= 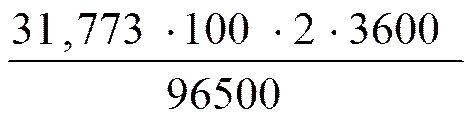 = 237,063 г.
= 237,063 г.
2.3. Аккумуляторы – устройства позволяющие многократно повторять операции зарядки и разрядки. Теоретически обратимым, после разрядки, может быть любой гальванический элемент, но восстановленная емкость для большинства гальванических элементов невелика.
Наилучшими эксплуатационными характеристиками обладают следующие аккумуляторы:
1) кислотные – свинцовые,
2) щелочные – никель-кадмиевые, железо-кадмиевые и серебряно-цинковые аккумуляторы.
1) Свинцовый аккумулятор
Электроды свинцового аккумулятора выполнены в виде ячеистых пластин из свинцового сплава; ячейки заполнены смесью свинцового глета (PbO) с глицерином. После заполнения аккумулятора электролитом (H2SO4) оксид свинца превращается в сульфат. При зарядке протекает электролиз, а при разрядке работает гальванический элемент:
Зарядка аккумулятора:
А) PbSO4 + 2H2O - 2e = PbO2 + SO42– + 4H+ ,
К) PbSO4 + 2e = Pb + SO42–.
Разрядка аккумулятора:
А) Pb + SO42– - 2e = PbSO4,
К) PbO2 + SO42– + 4H+ + 2e = PbSO4 + 2H2O.
Суммарное уравнение:
разрядка ®
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O, ЭДС = 2,0 В.
¬ зарядка
При разрядке аккумулятора расходуется серная кислота и образуется вода с плотностью примерно в два раза меньшей, что приводит к уменьшению плотности электролита. На измерении плотности электролита основан один из методов контроля степени разрядки аккумулятора.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 516; Нарушение авторских прав?; Мы поможем в написании вашей работы!