
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості
|
|
|
|
В зв'язку з тим, що ці сполуки мають дві функціональні групи їм характерні реакції взаємного впливу. Також вони одночасно виявляють властивості як карбонових кислот, так і альдегідів та кетонів.
1) Як кислоти вони дисоціюють:
Кд CH3COOH = 1,75 · 10-5 Кд  = 47 · 10-5
= 47 · 10-5
Кд пропіон.к-ти = 1,34 · 10-5 Кд піровиногр.к-ти = 320 · 10-5
За карбоксильної групи утворюються всі похідні карбонової кислоти: естери, хлорангідриди, нітрили тощо.
2) Як альдегідо- та кетокислоти:
а) взаємодія з аміаком:
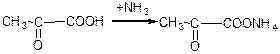
б) взаємодія з еtон:
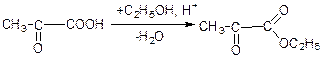
в) взаємодія з тіохлоридом:
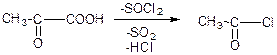
г) дисоціація:
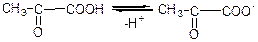
3) За оксогрупою:
а) гідрогенізація:
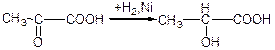
б) взаємодія з синільною кислотою:
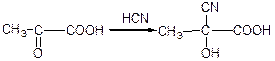
в) взаємодія з гідросульфітом натрію:
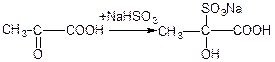
г) взаємодія з хлоридом фосфору (V):
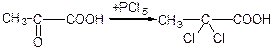
д) взаємодія с фенілгідразином:
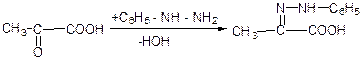
е) взаємодія з гідроксил аміном:
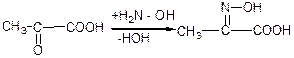
4) Взаємний вплив функціональних груп.
4. Ацеоцтовий естер. З похідних кетокислот найбільше значення має етиловий естер ацетооцтової кислоти. Він має широке значення в органічному синтезі.
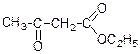
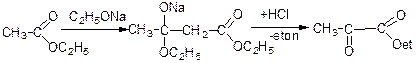
Ацетооцтовий ефір добувають нагріванням етилацетату з натрієм або етилатом натрію.
В даній реакції відбувається нуклеофільна атака карбону.
Будова ацетооцтового естеру – предмет дискусій хіміків протягом десятиліть.
Було запропоновано дві структури:
І кетоструктура
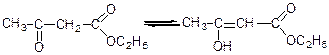
ІІ енольна структура
Згідно з формули І ацетооцтовий естер є одночасно і кетоном і естером.
Відповідно до формули ІІ ацетооцтовий естер є естером і ненасиченим спиртом – фенолом.
В деяких реакціях ацетооцтовий естер реагує як кетон:
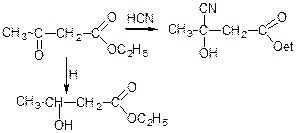
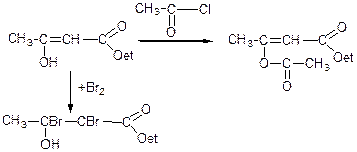
етиловий естер β-ацетооксикротонової кислоти
Властивості кето групи і фенолу (ненасичений зв'язок):
Ацетооцтовий естер дає характерну реакцію на фенол. При взаємодії з FeCl3 утворює фіолетове забарвлення.
Встановлено, що ацетооцтовий естер – суміш 2-х ізомерів: І (92,5%) і фенольна ІІ (7,5%). Обидва ізомери знаходяться в рівновазі один з одним. Явище, коли речовина може існувати у вигляді кількох ізомерних форм, які легко переходять одна в одну та знаходяться у взаємній рівновазі називається таутомерією.
Ізомери – таутомери.
Таутомерія, при якій відбувається взаємний перехід кетонної й енольної форми називається кетоенольною таутомерією.
Кетоенольна таутомерія залежить від різних чинників: t0, концентрації та природи розчинника.
Полярні розчинники сприяють зміщенню рівноваги в бік кетонної форми, а в неполярних розчинниках – в бік енольної форми.
Внутрішня енергія нижча для кетонної форми. Різниця між значеннями внутрішньої енергії кетонної і енольної форм становить близько 75 кДж/моль. Тому ненасичені спирти з гідроксилом біля sp2-гібридизованого атома вуглецю нестійкі і перегруповуються в енергетично стійкіші карбонільні сполуки (правило Ельтекова). Однак при утворенні фенолу виникає спряжена система подвійних зв'язків і внутрішньомолекулярний водневий зв'язок, які стабілізують фенольну форму:
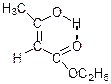
Ацетооцтовий естер розкладається під дією лугів. В залежності від умов проведення реакції ацетооцтовий естер розкладається по різному:
1) кетонне та кислотне розщеплення.
Кетонне (розбавлені розчини лугів або кислот):
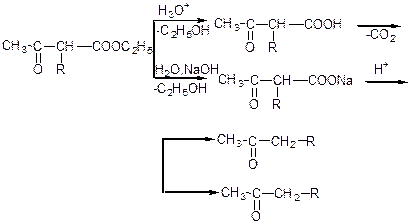
Кислотне (концентровані розчини лугів):
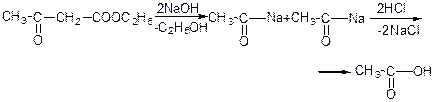
При дії натрію або алкоголятів утворюється натрій ацетооцтовий ефір:
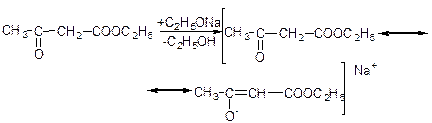
Натрійацетооцтовий естер виявляє двоїсту реакційну здатність: утворює два ряди похідних:
алкілування:
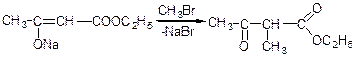
метилацетооцтовий ефір
Якщо на натрійацетооцтовий ефір подіяти хлористим ацетилом, то реакція відбувається за SN(2)-механізмом і в результаті утворюється С-ацетильна похідна ацетооцтового ефіру:
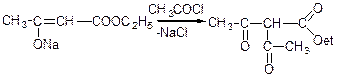
Етиловий ефір -ацетил- -кетомасляної кислоти
Якщо ж взаємодію натрійацетооцтового ефіру з хлористим ацетилом проводити за SN(2)-механізмом з участю О--нуклеофільного центру амбідетного аніона:
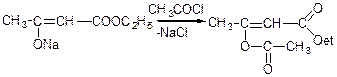
Література
1. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
2. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
3. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
4. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5349; Нарушение авторских прав?; Мы поможем в написании вашей работы!