
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість хімічних реакцій
|
|
|
|
Хімічні перетворення відбуваються в разі зіткнення молекул, якщо в результаті зіткнення перебудовуються хімічні зв’язки, тобто зв’язки у вихідних молекулах розриваються, а нові зв’язки утворюються. Швидкість хімічних реакцій характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії чи розкладу в одиницю часу в одиниці об’єму (для гомогенних дій) чи на одиницю поверхні поділу фаз (для гетерогенних реакцій).
Для гомогенних процесів, які здійснюються без зміни об’єму, швидкість хімічної реакції визначають як зміна концентрацій реагуючих речовин чи продуктів реакції за одиницю часу.
Зміна концентрацій дорівнює різниці між концентрацією С2, яка відповідає моменту часу t2, і вихідною (початковою) концентрацією С1 в момент часу t1. Тоді середня швидкість реакції дорівнює:
v
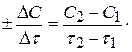
Концентрація речовин у процесі реакції весь час змінюється, а це впливає на її швидкість, тому слід розглядати миттєву швидкість реакції, тобто швидкість у даний момент часу. Для гомогенних реакцій – це похідна концентрації за часом.
v


| 
|
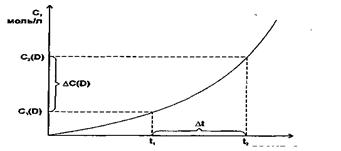
Оскількі швидкість хімічних реакцій завжди позитивна і характеризується зміною концентрацій реагируючих речовин (С2<С1), то величина DС (d C) буде негативною і відношення DС/Dt (dC/dt) треба брати з знаком “мінус”. Якщо швидкість реакції визначають за зміною концентрації одного з продуктів реакції, то величина DС позитивна і відношення DС/Dt (dC/dt) необхідно брати із знаком “плюс”. Швидкість хімічної реакції дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу:
v = tg a.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора і деяких інших зовнішніх факторів.
3. Залежність швидкості реакції від концентрації реагуючих речовин - закон діючих мас
Необхідною умовою перебігу хімічної реакції поміж двома речовинами є зіткнення їх молекул. Швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об’єму. Ймовірність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин.
Таким чином, швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин в ступенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції.
Ця закономірність була встановлена експериментально у 1867 р. Гульбергом і Вааге і носить назву закона діючих мас (ЗДМ). Діючими масами на той час називали концентрації речовин.
Для взаємодії двох молекул, наприклад водню і йоду за рівнянням
Н2 + I2 = 2HI,
в элементарному акті якої приймають участь по одной молекулі, ЗДМ в математичній формі має вираз:
v = k C(H2)C(I2).
Для реакції
2NO + Cl2 = 2NOCl
швидкість v = k C2(NO)C(I2).
Для загальної реакції
a A + b B = c C + d D
швидкість дорівнює:
v = k Ca(A)Cb(B) = k [A]a[B]b.
Величина k – коефіцієнт пропорційності поміж швикістю і концентрацією і називається константою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості за сталої температури величина стала і характеризуєть природу реагуючих речовин.
Константа швидкості – це швидкість реакції за умови, що концентрації реагуючих речовин дорівнюють 1 моль/л.
Рівняння, що пов’язує швидкість реакції з концентраціями реагентів, називають рівнянням швидкості, або кінетичним рівнянням реакції.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники ступеню в законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо простий приклад. Фотохімічний розклад газоподібного НBr перебігає за стехіометричним рівнянням
2HBr (г) = Н2 (г) + Br2 (г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул HBr. Насправді ця фотохімічна реакція здійснюється за таким механізмом:
HBr + hv = H + Br;
H + HBr = H2 + Br;
Br + Br = Br2.
Таким чином, ніякого зв’язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками ступенів в кінетичному рівнянні, зовсім немає. Схожість, що спостерігається для деяких реакцій, має випадковий характер.
Перебіг більшості хімічних реакцій такий, що утворення продуктов відбувається через ряд проміжних елементарних стадій (послідовних чи паралельних), які можна вважати елементарними реакціями. Кожна з цих реакцій описується своїм кінетичним рівнянням. В таких випадках залежність швидкості від концентрації може виявитися дуже складною. Ситуація спрощується, якщо яка-небудь з цих стадій пребігає набагато повільніше від інших. Тоді вступає в силу один з важливих принципів кінетики – принцип лімітуючої стадії: швидкість складної реакційї визначається швидкістю найповільнішої (лімітуючої) елементарної стадії.
Цей принцип ще називають принципом бутилочного горлушка, вузького місця, вузького містка, тощо. Дійсно, якщо вода виливається через систему отворів, то швидкість всього процесу буде визначатися швидкістю її проходження крізь самий вузький отвір. Середня швидкість автомобіля на жвавій автомагістралі залежить від швидкості руху через “пробки” – місця, де збирається багато машин. Якщо взвод солдат біжить крос, то результат взводу визначається швидкістю бігу найповільнішого солдату.
Сума показників ступенів в рівнянні швидкості хімічної реакції (кінетичного рівняння) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Окремі показники ступенів концентрацій реагентів визначають порядок реакції щодо даної речовини.
Визначити порядок реакції можна графічно. Наприклад, маємо кінетичне рівняння 
 , де n-порядок реакції за речовиною А. Прологарифмуємо це рівняння отримаємо: ln v = ln k + n ln CA. Графіком цього рівняння є пряма лінія, тангенс кута нахила якої і є порядком реакції за речовиною А.
, де n-порядок реакції за речовиною А. Прологарифмуємо це рівняння отримаємо: ln v = ln k + n ln CA. Графіком цього рівняння є пряма лінія, тангенс кута нахила якої і є порядком реакції за речовиною А.
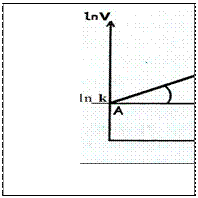
n=tgA=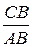
Якщо порядок нулевий (швидкість не залежить від концентрації реагуючих речовин), то v = k чи  . Тоді розмірність константи швидкості моль/л×с
. Тоді розмірність константи швидкості моль/л×с
Це, наприклад, реакція розкладу кальцій карбонату: CaCO3®CaO+CO2.
Швидкість реакції першого порядку описується кінетичним рівнянням
v = k C.
Розмірність константи визначається 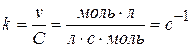
Якщо у лівій частині рівняння записати значення швидкості через зміну концентрації реагуючої речовини за одиницю часу, то отримаємо:
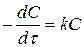 .
.
Щоб знайти залежність концентрацій реагентів від часу, потрібно розв’язати отримане диференціальне рівняння, таким чином після інтегрування ми отримаємо інтегральне рівняння для кінетичного рівняння першого порядку
ln C = ln C0 - kt (графік пряма лінія залежності lnC від t, тангенс кута нахилу якої дорівнює –k)
чи
kt = ln(C0/C).
Прикладом реакції першого порядку є розклад нітроген (V) оксиду:
N2O5 = 2NO2 + 1/2O2.
Для реакцій другого порядку кінетичне рівняння має вигляд
v = k C2; v = k CACB
Для визначення розмірності константи 
Чи інша форма записум  .
.
Інтегрування цього рівняння дає таку залежність концентрації речовини від часу перебігу реакції
1/C=1/C0 + kt (пряма лінія, tg a дорівнює k)
чи
kt = 1/C - 1/C0
Прикладом реакції другого порядку є взаємодія водня і йода
H2 + I2 = 2HI
розклад нітроген (IV) оксиду: 2NO2 = 2NO + O2.
Реакції третього порядку описуються кінетичними рівняннями
v = kC3 = kC12C2 = kC1C2C3.
Залежність концентрації від часу виражається рівнянням:
1/C – 1/C
– 1/C = 2kt
= 2kt
Прикладом таких реакцій є:
2NO + O2 = 2NO2;
2NO + Br2 = 2NOBr.
Порядок реакції загалом визначає характер математичної залежності швидкості реакції від концентрації реагентів. Порядок реакції, тобто сума показників ступенів в кінетичному рівнянні, як правило, може приймати дробові значення.
Елементарний акт реакції відбувається внаслідок зіткнення молекул. Для характеристики механізму реакцій застосовують поняття молекулярності реакції.
Число молекул, які беруть участь в елементарному акті реакції, називають молекулярністю реакції.
Реакція, для перебігу якої необхідна тільки одна молекула, называється мономолекулярною реакцією. Це реакція розкладу чи перегрупування, наприклад:
I2 = 2I;
HBr = H + Br;
N2O5 = 2NO2 + 1/2O2.
Для бімолекулярної реакції для елементарного акту потріюна наявність двох часток (молекул, іонів, атомів):
H2 + I2 = 3HI.
В тримолекулярній реакції реагують одночасно три молекули (ці реакції трапляються дуже рідко):
2NO + O2 = 2NO2.
Реакція, молекулярність яких більше трьох, не буває, оскільки одночасно зіткнення в одній точці чотирьох і більше молекул малоймовірно. Фактично всі елементарні хімічні реакції є мономолекулярними чи бімолекулярними, тобто всі реальні хімічні реакції дуже прості, не враховуючи іноді складності сумарних стехіометричних рівнянь. Таким чином, сумарна форма рівняння хімічної реакції не відоюражає складності і багатостадійності процесу, який може складатися з декількох елементарних реакцій різного порядку.
Наприклад, для реакцій:
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O;
2C4H10 + 13O2 = 8CO2 + 10H2O
Суми коефіцієнтів перед формулами вихідних речовин дорівнюють відповідно 18 і 15, але це не означає, що в елементарних актах цих реакцій беруть участь такі кількості молекул. Такі реакції відбуваються за багатьма стадіями, кожна з яких моно- чи бімолекулярна.
Завдання. Написати кінетичні рівняння для реакцій (закон действующих масс)
а)СaO(к) + СО2(г) = СаСО3(к);
б)В2Н6(г) + 6Сl2(г) = 2ВСl3(г) + 6НСl;
в)2SO2(г) + О2(г) = 2SO3(г);
г)NH4Cl(к) = NH3(г) + HCl(г).
4. Вплив температури на швидкість реакцій. Енергія активації
Як зазначалося, умовою елементарного акта взаємодії є зіткнення реагуючих часток. Однак не кожне зіткнення може привести до хімічної взаємодії. Насправді, хімічна взаємодія передбачає перерозподіл електронної густини, утворення нових хімічних зв’язків і перегрупування атомів. Таким чином, крім зіткнення енергія реагуючих часток повинна бути більша за енергію відштовхування (енергетичний бар’єр) між їх електронними оболонками.
Внаслідок перерозподілу енергії частина молекул в системі завжди має певний надлишок енергії порівняно із середньою енергією молекул. Тому вони можуть подолати енергетичний бар’єр і вступити в хімічну взаємодію. Такі реакційноздатні молекули называють активними молекулами.
Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається е нергією активації реакции.
Вона необхідна для подолання енергетичного бар’єра.
Наявність енергетичного бар’єра приводить до того, що багато реакцій, перебіг яких повністю можливий, самочинно не починається. Наприклад, вугілля, деревина, нафта, здатні окиснюватися і горіти на повітрі, за звичайних умов не спалахують. Це пов’язано з великою енергвєю активації відповідних реакцій окиснення. Підвищення температури збільшує кількість активних молекул, і тому все більше молекул кисню, вугілля, деревини в нафти набувають необхідний запас енергії для початку реакції. За певної температури швидкість реакції досягає певної величини, і починається реакція горіння.
Перш ніж почнуть утворюватись нові хімічні зв'язки, мають бути ослаблені або розірвані зв'язки між атомами у вихідних молекулах. Для цього потрібно затратити енергію. Так, у реакції водню з йодом
Н2 + І2 = 2НІ
під час зіткнення молекул починають подовжуватись зв'язки Н—Н та І—І. Вони послаблюються і тільки після цього починають утворюватись нові зв'язки Н—І. У результаті виникає угруповання
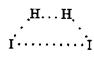
яке називають активованим комплексом, або перехідним станом.
Після утворення перехідного стану відбувається процес подальшої побудови нових зв'язків і остаточного розриву вихідних зв'язків. Процес хімічного перетворення можна відобразити такою схемою:

Зміну енергії реагуючих часток під час хімічного перетворення можна відобразити на енергетичній діаграмі, абсцисою якої є координата реакції, пов'язана з між'ядерними відстанями
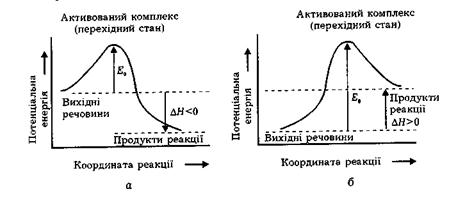
Таким чином, під час хімічного процесу перехід системи вихідних речовин із енергетичного стану Евих в енергетичний стан Епр здійснюється через енергетичний бар’єр, який дорівнює енергії активації системы Е0. При цьому тепловий ефект реакції
DН = Епр – Евих.
Для ендотермічної реакції енергія продуктів реакції більша, ніж енергія вихідних речовин, для екзотермічної, навпаки, енергія продуктів менша за енергію вихідних речовин (див. рис.). Однак в обох випадках між вихідними речовинами і продуктами реакції утворюється активований комплекс, що має підвищену енергію.
Різницю енергій перехідного стану і вихідних речовин називають енергією активації, або потенціальним бар'єром, реакції.
Іншими словами, енергія активації — це найменша енергія, потрібна для такого послаблення зв'язків у вихідних молекулах, після якого енергія утворення нових зв'язків переважає затрати енергії для подальшого послаблення вихідних зв'язків. Утворення перехідного стану — процес енергетичне вигідніший, ніж повний розрив зв'язків у вихідних молекулах. Для більшості реакцій енергія активації менша за енергію, потрібну для розриву навіть найслабкішого зв'язку у вихідних молекулах.
Отже, у хімічному перетворенні можуть брати участь не всі молекули, а тільки так звані активні, тобто ті, що мають енергію, достатню для утворення перехідного стану.
Енергія активації DЕакт – важливая характеристика хімічних перетворень. Саме енергія активації затримує чи робить неможливими багато реакцій, які з точки зору термодинаміки можуть перебігати самочинно. Якщо б енергія активації для всіх реакцій дорівнювала нулю, то в природі відбувалася безлічь хаотичних хімічних, реакцій, для яких DG негативна. Так, вугілля і нафта при контактв з повітрям загоралися б, азот повітря і вода утворювали б розчин нітратної кислоти, живі б клітини зруйнувалися внаслідок гідролізу.
Таким чином, існування більшості молекул, кристалічних речовин і навіть живі клітини можливо тому, що процеси їх перетворення і руйнування пов’язані з подоланням значного енергетичного бар’єра.
Підвищення температури реагуючих часток внаслідок зростання швидкості молекул зумовлює зростання загальної енергії системи і відповідно збільшення відносного вмісту активних молекул, що рівноцінно зростанню швидксоті хімічної реакції. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і енергії активації Еакт:
 ,
,
або у логарифмічній формі
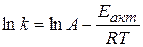
де А – множник Арреніуса чи частотний фактор, пропорційний числу зіткнень молекул.
Якщо концентраці реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса надає можливість виразити залежність швидкості реакції від температури:
v .
.
Оскільки у рівнянні температура входить в показник ступеню, то швидкість хімічних реакцій в значній мірі залежить від зміни температури.
Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: з підвищенням температури на кожні 10 градусівшвидкість реакції зростає в 2-4 рази.
В математичній формі правило Вант-Гоффа записується так:

де D t – різниця (зростання) температур; v1 – швидкість реакції до підвищення температури; v2 – швидкість реакції після підвищення температури (при температурі t 2); g - температурний коефіцієнт швидкості реакції (g=2…4).
Температурний коефіцієнт показує, у скільки разів зросте швидкість реакції у разі підвищення температури на 10 градусів.

|
Це рівняння є наближеним, оскільки швидкість реакції, крім температури залежить також від енергії активації, яка, в свою чергу, залежить від температури.
Каталіз
Каталізатор — це речовина, яка бере участь у проміжних стадіях, змінює швидкість реакції, але не входить до складу продуктів реакції і залишається після реакції в незмінній кількості.
Каталізатори майже завжди підвищують швидкості реакцій. Вони мають величезне значення в промислових і лабораторних хімічних процесах, а також у хімічних реакціях, що відбуваються в живих організмах, атмосфері, океанах.
Так, у зелених листках рослин під дією особливих каталізаторів — ферментів — з вуглекислого газу і води з поглинанням сонячного світла синтезуються різноманітні складні органічні сполуки. В організмі людини за участю ферментів відбуваються складні процеси перетворення хімічних сполук, що забезпечують життєдіяльність організму. Без каталізаторів неможливо було б добувати аміак, сірчану та азотну кислоти, більшість продуктів органічного синтезу.
Саме тому прогрес у хімічній промисловості значною мірою пов'язаний з розробкою нових каталізаторів, застосування яких забезпечило б збільшення виходу продуктів реакцій з одночасним зменшенням енергозатрат і кількості відходів, захистом навколишнього середовища від забруднення, відкриттям нових можливостей у галузі синтезу багатьох цінних речовин.
Швидкість реакції істотно залежить від енергії активації, причому зменшення енергії активації (потенціального бар'єру) забезпечує зростання швидкості. Здебільшого дію каталізаторів пояснюють тим, що вони знижують енергію активації. Каталізатор бере участь у проміжних стадіях реакції, змінює шлях реакції. За наявності каталізатора виникають інші активовані комплекси, для утворення яких потрібна менша енергія, ніж для утворення активованих комплексів без каталізатора. Наприклад, якщо деякій реакції
А + В = АВ (Ea)
відповідає певна енергія активації Еа то за наявності каталізатора К речовина А спочатку утворює з ним нестійку сполуку:
А + К = А...К (Е'а),
яка далі реагує з речовиною В з виділенням каталізатора К й утворенням кінцевого продукту:
А...К + В = АВ + К (Еа).
Значення енергії активації проміжних стадій (Е'а та Е'а) менші за енергію активації реакції, яка відбувається без каталізатора, тому більша частка молекул матиме достатню енергію для утворення активованих комплексів, що виникають за наявності каталізатора.
Схема, що відображає різницю енергій активації стадій каталітичного процесу і того самого процесу, який відбувається без каталізатора, наведено на
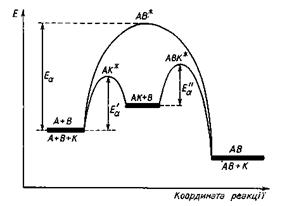
|
рис..
Розрізняють два види каталізу — гомогенний і гетерогенний. У гомогенному каталізі каталізатор і речовини, що беруть участь у реакції, утворюють одну фазу (газ або розчин). У гетерогенному каталізі каталізатор перебуває в системі у вигляді самостійної фази. Прикладом гомогенного каталізу є наведена вище реакція розкладу ацетальдегіду за наявності йоду (всі речовини за підвищеної температури перебувають у газоподібному стані), гетерогенного — розклад йодоводню за наявності золота або платини.
Реакція 2Н2О2 = 2Н2О + О2, яка відбувається у водному розчині, прискорюється в разі додавання іонів ОН- (розчину лугу), вільного Вr2 або твердого МnО2, тобто для однієї й тієї самої реакції можливий і гомогенний, і гетерогенний каталіз.
У хімічній промисловості найширше „застосовують гетерогенний каталіз. Найчастіше — це газові реакції, що відбуваються на поверхні твердих каталізаторів. Перевага цього виду каталізу полягає в тому, що каталізатор нескладно відокремити від продуктів реакції і вихідних речовин, які не прореагували. У каталізатора має бути велика («розвинута») поверхня. Це означає, що якісний каталізатор має пористу структуру або перебуває в дуже подрібненому (високодисперсному) стані. На практиці каталізатори наносять на спеціальні носії (алюмосилікати, силікагель, оксид алюмінію та ін.), які мають дуже розвинуту поверхню. В порах цих носіїв мають формуватися активні центри, тобто такі угруповання атомів, на яких і відбувається задана реакція. Створенню активних центрів сприяють спеціальні активуючі добавки, які називають промоторами. Так, невелика добавка сульфатів лужних металів значно підвищує активність V2O5 — каталізатора окиснення SO2 до SO3; добавки Аl2О3 та К2О — активність заліза, що є каталізатором синтезу аміаку.
Активність каталізаторів значно зменшується за наявності в газовій суміші каталітичних отрут — домішок, які міцно зв'язуються з активними центрами каталізатора і перешкоджають реакції. Прикладом можуть бути домішки сірководню в азо-товодневій суміші, який є каталітичною отрутою в разі добування аміаку. З огляду на це вихідні газові суміші ще до контакту з каталізатором слід дуже ретельно очищати від цих шкідливих домішок.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3264; Нарушение авторских прав?; Мы поможем в написании вашей работы!