
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Нітроген. Якісний аналіз третьої аналітичної групи аніонів
|
|
|
|
Галогени. Якісний аналіз другої аналітичної групи аніонів.
Другу аналітичну групу утворюють р- елементи, розміщені у верхньому правому куту періодичної таблиці Д.І. Менделєєва. Це сульфур і галогени. Цим елементам властива здатність утворювати сполуки з гідрогеном (сірководень, хлоридна кислота, йодоводень, бромноводень), які розчиняються у воді. Ці сполуки у водному розчині мають кислотні властивості, тому їх розчини називаються кислотами.
Особливості електронної будови цих аніонів у тому, що вони мають восьмиелектронний або благородно газовий зовнішній електронний рівень:
16Ѕ2- [10Nе] 3s23р6
35Br-[18Аr ] 3d104s24р6
17СІ - [10Nе] 3s23р6
53І -[36Кr ] 4d105s25р6
Аніони безбарвні, мають вільні пари електронів, великі радіуси.
Аg+ (АgNО3) – є груповим реактивом на аніони ІІ аналітичної групи. За окисно – відновними властивостями аніони ІІ групи відновники, при цьому найлегше окиснюються різними окисниками до утворення вільних простих речовин.
Характерні реакції СІ –
Більшість хлоридів розчинні у воді. Нерозчинні або малорозчинні: АgСІ, РbСІ2,
Нg2СІ2, СuСІ, ВіОСІ, ЅbОСІ, АuСІ, РtСІ4.
1. Аg+ з хлорид аніоном утворює білий сірнистий осад, який розчиняється в амоніаку, амоній карбонаті, тіосульфаті натрію:
СІ- + Аg+ = АgСІ↓
АgСІ + (NН4)2СО3 = [Аg(NН3)2]СІ + Н2О + СО2
АgСІ + 2NН3 = [Аg(NН3)2]СІ
При додаванні нітратної кислоти випадає білий осад:
[Аg(NН3)2]СІ + 2НNО3 = АgСІ ↓ + 2 NН4NО3
Характерні реакції Вr –
Розчинність бромідів аналогічна розчинності хлоридів
1. Аg+ з бромід аніоном утворює жовтий осад, який погано розчиняється в амоніаку
Br- + Аg+ = Аg Br↓
2. Окиснення бромід – аніона окисниками (хлорна вода, перманганат калію)до вільного брому.
10Br- + 2МnО4- + 16Н+ = Br2+ 2Мn2+ + 8Н2О
Характерні реакції І –
Розчинність йодидів майже аналогічна розчинності хлоридів і бромідів.
1. Аg+ з йодид аніоном утворює жовтий осад, який не розчиняється в амоніаку, легко розчиняється в тіосульфаті натрію
І - + Аg+ = Аg І↓
2. Окиснення йодид – аніона окисниками до вільного йоду.
А)10 І- + 2МnО4- + 16Н+ = 5І2+ 2Мn2+ + 8Н2О
Б) 2Fе3+ + 2І- = І2 + 2 Fе2+
Виділений йод виявляють за забарвленням шару органічного розчинника у фіолетовий колір або йодкрохмальним папірцем.
Ацетат – або етаонат – аніон - це кислотний залишок органічної насиченої монокарбонової ацетатної (етанової) кислоти СН3СООН.
Всі аніони третьої групи безбарвні.
Характерні реакції СН3СОО –
Ацетати майже всі розчинні у воді. Малорозчинними є: СН3СООАg, Fе(ОН)2СН3СОО, АІ(ОН)2СН3СОО
1. Fе3+ з ацетат – аніоном утворює розчин темно - червоного кольору:
3СН3СООNа + FеСІ3 = Fе(СН3СОО)3 + 3NаСІ
3СН3СОО- + Fе3+ = Fе(СН3СОО)3
Умови: відсутність СО32-; РО43- ; ЅО32-; ЅіО32- - аніонів
2. Концентрована сульфатна кислота при взаємодії з ацетат – йонами утворює вільну ацетатну кислоту, яку розпізнають за специфічним запахом оцту:
2СН3СООNа + Н2ЅО4 = СН3СООН↑ + Nа2ЅО4
3. Етанол з ацетатною кислотою утворює етилацетат, який розпізнають за запахом:
2СН3СООNа + Н2ЅО4 = СН3СООН↑ + Nа2ЅО4
СН3- СО ОН + Н - О- С2Н5 = СН3 - СООС2Н5 + Н2О
Характерні реакції NО2 –
Більшість солей нітрітної кислоти добре розчинні у воді. Малорозчинний АgNО2. нерозчинні: К3[Со(NО2)], К2Nа [Со(NО2)]. Чиста нітритна кислота у вільному стані не існує.
1. Концентрована або розведена сульфатна кислота розкладає всі нітрити з виділенням бурих газів
NаNО2 + Н2ЅО4 = NаНЅО4 + НNО2
3НNО2 → НNО3 + 2NО↑ + Н2О
2NО + О2 = 2NО2↑
2. Перманганат калію в кислому середовищі окислює нітрит до нітрату (розчин знебарвлюється)
5NО2- + 2МnО4- + 6Н+ = 5NО3-+ 2Мn2+ + 3Н2О
3. Антипірин з нітрит аніоном утворює нітрозоантипірин смарагдово – зеленого кольору
антипірин



 NО2- Н3С С С NО
NО2- Н3С С С NО

 Н+
Н+
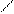



 Н3С N С О
Н3С N С О
 N
N
С6Н5
Характерні реакції NО3 –
Всі солі нітратної кислоти добре розчиняються у воді за винятком ВіО (NО3), Нg(ОН) (NО3), тому не можна відкрити нітрати реакціями осадження. Проте катіони органічних речовин з нітрат – аніоном утворюють осади малорозчинних солей. Нітрати окисники лише у твердому стані.
1. Дифеніламін з нітрат аніоном утворює інтенсивно – синє забарвлення
Умови: Відсутність окисників, відновників, нітрит – аніону.
Література
Основна література.
1. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607 с.
2. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
3. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
4. Логинов Н.Я. Аналитическая химия. /Логинов Н.Я., Воскресенський А.Г., Солодкин, И.С./ – М.: “Просвещение”, 1975. – 477с.
Додаткова література.
5. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
6. Омелян В.І, Шешеня С.К. Навчальний комплекс з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. загальні основи аналітичної хімії. Для віртуально-тренінгової технології самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”, 7.00503.02 “Товарознавство та експертиза в митній справі”. – Полтава: РВВ ПУСКУ, 2002. – 179.
7. Омелян В.І. Опорний конспект лекцій з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. Загальні основи аналітичної хімії для студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі” та МІПК. – Полтава: РВВ ПУСКУ, 2003. – 60.
8. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!