
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Частина 1
|
|
|
|
Дефекти і брак при термічній обробці
Технологічні процеси термічної обробки деталей повинні відповідати таким основним вимогам:
- забезпечувати необхідну зміну властивостей при гарантованій надійності результатів термообробки;
- зберігати, по можливості, незмінними інші властивості виробів, а саме первинну геометричну форму, розміри і якість поверхні.
Найбільш розповсюдженими видами дефектів, що виникають в результаті термообробки це деформації, жолоблення і тріщини, які виникають в результаті внутрішніх термічних напруг. Ефективно цьому запобігати можливо повільним охолодженням в області мартенситних перетворень. Сприяє зниженню цього виду дефектів створення деталей невеликих розмірів, спрощеної форми, без гострих кутів і різких переходів. Більш складні за формою деталі слід виготовляти із легованих сталей, які загартовують в маслі.
При недогріванні деталі або малій витримці при температурі гартування структура не набирає достатньої твердості. Також причиною цього може бути недостатня кількість вуглецю або невеликий ступінь переохолодження, в результаті чого структура частково або повністю складається із трооститу або сорбіту. Для усунення цих дефектів необхідно підвищувати температуру нагрівання або збільшувати час витримки, а також застосовувати більш інтенсивне охолодження.
Гартування при перегріванні призводить до підвищення крихкості деталі, що пояснюється зростанням величини зерен аустеніту. Усунення такого дефекту досягається повторним гартуванням від нормальних для даної сталі температур.
Для зменшення дефекту окислення і зневуглецювання поверхневих шарів термічно оброблюваних деталей застосовують гартування в термопечах із створенням штучно контрольованої атмосфери.
ТЕОРІЯ ТЕРМІЧНОЇ ОБРОБКИ
Тема 1. Загальна характеристика термічної обробки
1. Роль термічної обробки у матеріалознавстві
2. Класифікація видів термічної обробки
3. Основні положення теорії термічної обробки
Роль термічної обробки у матеріалознавстві
Фізико-механічні і технологічні властивості металів і сплавів на практиці не задовольняють умовам виготовлення або експлуатації деталей (виробів) продукції машинобудування. Щоб змінити вказані властивості в бажаному напрямі, застосовують термічну обробку.
Термічною обробкою називають сукупність послідовних технологічних процесів нагрівання, витримки і охолодження металевих виробів з метою зміни їх фізико-механічних властивостей шляхом керованих структурних перетворень.
Під дією теплової енергії при термічній обробці в металах і сплавах відбуваються внутрішні перетворення, які призводять до зміни мікроструктури в цілому, а саме будови і кількості фаз та розмірів зерен. Причому, після припинення теплової дії структурні зміни не зникають.
Академік Андрій Анатолійович Бочвар запропонував визначати види термічної обробки за структурними перетвореннями.
Класифікація видів термічної обробки
А. А. Бочвар визначив такі види термічної обробки металів та сплавів залежно від характеру теплової дії:
§ Власне термічна обробка (ТО) без зміни хімічного складу;
§ Термомеханічна обробка (ТМО), яка об’єднує термічну дію і пластичне деформування;
§ Термо-хімічна обробка (ТХО), при якій під дією високих температур і дифузійних процесів досягають зміни хімічного складу поверхневих шарів з подальшою їх термообробкою.
Режим термічної обробки включає стадії нагрівання до певної температури, витримки при заданій температурі протягом певного часу і охолодження із заданою швидкістю.
Термо-механічна обробка є розвитком ТО, коли на метал (сплав) накладаються ще й деформації.
Термо-хімічна обробка передбачає комбінацію термічного та хімічного впливу на метали (сплави) для зміни хімічного складу та властивостей у поверхневих шарах.
Основні положення теорії термічної обробки
Метою термічної обробки металів (сплавів) є зменшення залишкових механічних, термічних або деформаційних напруг у виробах, зменшення внутришньокристалічної ліквації у відливках, часткове або максимально можливе підвищення твердості та міцності.
Залежно від поставленої задачі застосовують різні методи термічної обробки.
Графічно режим термічної обробки може бути представлений в координатах „температура – час” (рис. 1.1).
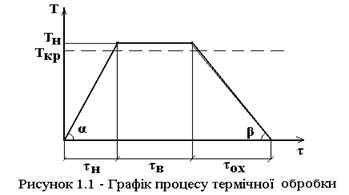
Режим термічноъ обробки характеризується такими основними параметрами:
τн – час нагрівання;
τв – час витримки;
τох – час охолодження;
Ткр – критична температура;
Тн – температура нагрывання;
Vн – швидкість нагрівання;
Vох – швидкість охолодження.
Це найпростіший вид термічної обробки. Більш складні процеси включають декілька нагрівань, ступінчасте нагрівання, охолодження до низьких температур.
Всі види термічної обробки залежно від характеру впливу на властивості сплавів поділяються на 4 групи:
Перша група – відпали першого роду без фазових перетворень. Цей вид термообробки полягає в нагріванні металу, або сплаву, який знаходиться в нерівноважному стані, з метою приведення його в рівноважний стан. (Причинами попереднього нерівноважного стану можуть бути деформування або неоднорідність зеренного складу.).
Друга група – відпали другого роду, при проведенні яких відбувається фазова перекристалізація. Якщо в сплавах при нагріванні проходить фазове перетворення, то нагрівання вище певної (критичної) температури викликає зміну структурної будови сплаву. (При повільному охолодженні проходить зворотнє перетворення – утворюється рівноважний і стабільний фазовий склад).
Третя група – гартування – вид термічної обробки, при якому (також як і для другої групи) нагрівання викликає фазову перекристалізацію, але в результаті штучного швидкого охолодження зворотнє фазове перетворення не встигає пройти. Отримана при цьому структура являється зафіксованим високотемпературним станом. Такий стан є нерівноважним і нестійким.
Четверта група – відпуски – види термообробки, в результаті проведення яких знімається нерівноважний стан в попередньо загартованих сплавах. Досягається це нагріванням нижче температури фазових перетворень. Якщо відпуск відбувається при кімнатній температурі або при невисокому нагріванні (до 50 – 150 °С), його називають старінням. Старіння – це різновид відпуску. Відпуск і старіння є вторинними операціями, які проводять після гартування.
Теоретичною основою для вивчення і проведення процесів термічної обробки є діаграми стану. За їх допомогою з’ясовують принципову можливість проведення процесу термообробки, визначають температурні режими їх проведення.
Виділяють 3 основні групи сплавів:
1. Сплави, в яких не відбуваються фазові перетворення в твердому стані (рис. 1.2).
2. Сплави, в яких розчинність компонентів змінюється в твердому стані
3. Сплави, в яких відбуваються евтектоїдні перетворення.
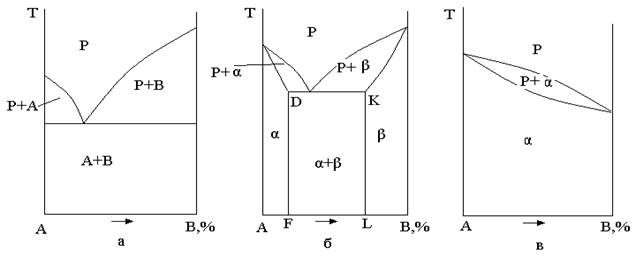
Рисунок 1.2 – діаграми стану сплавів, в яких не відбуваються перетворення в твердому стані
Метою термообробки є підвищення пластичності і отримання структури, близької до рівноважної або, навпаки, отримання нерівноважної структури з високою міцністю і твердістю.
Аналіз діаграм стану дозволяє зробити висновок про можливість термічної обробки сплавів.
1. Для сплавів, в яких не відбуваються фазові перетворення в твердому стані (рис. 1.2), застосовують лише термообробку першого роду (відпал без фазових перетворень).
Стан таких сплавів після теплової дії стає більш рівноважним, підвищується пластичність, зменшується неоднорідність складу.
2. В сплавах зі змінною розчинністю компонентів в твердому стані і в сплавах з евтектичними перетвореннями при нагріванні виникають необхідні умови для створення в подальшому, в процесі охолодження, нерівноважної структури, здатної до зміцнення.
Тема 2. Аналіз діаграм стану сплавів
1. Типи взаємодії між компонентами сплаву.
2. Типові діаграми стану сплавів.
3. Зв’язок діаграм стану з властивостями сплавів.
1. Типи взаємодії між компонентами сплаву
Сплав – це речовина, яку отримують сплавленням двох чи більшої кількості компонентів.
Компоненти – речовини, з яких складається сплав. Компонентом може бути хімічний елемент або хімічна сполука.
Залежно від фізико-хімічної взаємодії компонентів у твердому стані можуть утворюватися наступні фази: тверді розчини і хімічні сполуки (фаза – це однорідна частина сплаву, відділена від інших частин поверхнею поділу, при переході через яку властивості змінюються стрімко).
Твердий розчин – це фаза, при утворенні якої всі компоненти взаємно розчиняються один в одному у твердому стані, і атоми одного з них певним чином розміщуються у кристалічній решітці іншого. Компонент, що є основою твердого розчину і зберігає свою кристалічну решітку, називається розчинником. Компонент, атоми якого певним чином розміщуються у кристалічній решітці розчинника, називається розчиненою речовиною.
Залежно від способу розміщення атомів розчиненої речовини у решітці розчинника розрізняють два основні види твердих розчинів: заміщення (рис. 2.1 а) і втілення (рис. 2.1 б).
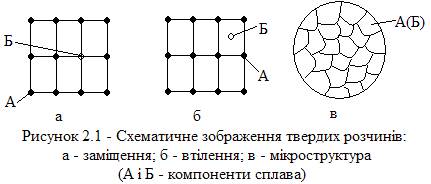
Тверді розчини втілення утворюють з металами компоненти, що мають малий розмір атомів (С, N, B, H). Тверді розчини заміщення утворюють метали, у яких близькі розміри атомів.
За кількістю розчиненої речовини тверді розчини поділяються на тверді розчини обмеженої і необмеженої розчинності.
Тверді розчини з необмеженою розчинністю – це сплави, де в одному компоненті (розчиннику) може розчинитися необмежена кількість розчиненої речовини.
Ті сплави, для яких характерна обмежена розчинність речовини у розчиннику, відносяться до твердих розчинів з обмеженою розчинністю.
Тверді розчини втілення бувають тільки обмеженої розчинності, а тверді розчини заміщення можуть бути обмеженої та необмеженої розчинності.
Хімічна сполука – це фаза, при утворенні якої атоми одного компонента при певному кількісному співвідношенні вступають в хімічну взаємодію з атомами другого компонента, при цьому утворюється новий тип кристалічної решітки. Кожній хімічній сполуці притаманна певна хімічна формула.
Коли компоненти сплаву у твердому стані не взаємодіють один з одним, вони утворюють механічну суміш.
Механічна суміш – це сплав, що складається з кристалів компонентів, які не взаємодіють між собою.
Кристалічну решітку і мікроструктуру механічної суміші можна представити як показано на рис. 2.2.

2. Типові діаграми стану сплавів
Описані в п. 1 різні типи взаємодії між компонентами сплавів породжують різноманітність сплавів. Для їх систематизації використовують діаграми стану.
Діаграма стану – це графічне зображення стану сплавів (із заданих компонентів) при різних температурах.
Для побудови діаграм стану використовують метод термічного аналізу. Для цього будуються криві охолодження, по яких визначають критичні точки (рис. 2.3).
Збільшення температури вище критичних значень призводить до переходу речовини в рідинний стан і навпаки, при охолодженні рідини нижче Ткр переводить її в кристалічний стан.
На кривих охолодження при температурах Ткр утворюються горизонтальні ділянки, які свідчать про те, що теплота, розсіювана в процесі охолодження компенсується схованою теплотою кристалізації, яку віддають утворювані кристали решітки. Це та частина енергії, яка раніше (при нагріванні)була витрачена на руйнування решітки.

Таким чином, критичні точки – це температури переходу речовини (сплаву) з одного фазового стану до іншого.
Розглянемо типові діаграми стану, побудовані за допомогою кривих охолодження.
Найбільш поширеними для сплавів є такі типи стану:
1. Діаграма стану сплавів, компоненти яких зовсім не розчиняються в твердому стані і утворюють механічну суміш (рис. 2.4 а);
2. Діаграма стану сплавів, компоненти яких повністю розчиняються в твердому стані (рис. 2.4 б);
3. Діаграма стану сплавів, компоненти яких обмежено розчиняються в твердому стані (рис. 2.4 в);
4. Діаграма стану сплавів, компоненти яких утворюють при кристалізації хімічні сполуки (рис. 2.4 г).
На рис. 2.4 показані ці типи діаграм стану і відповідні графіки зміни механічних властивостей сплавів.
Перший тип діаграми стану (рис. 2.4 а) можна розглянути для сплаву Pb – Sb. При певній концентрації (13 % Sb) утворюється евтектика (точка С) з елементами А і В. Компонентами А і В, які складають сплав, можуть бути як чисті елементи, так і хімічні сполуки.
Всі сплави, на відміну від чистих компонентів, кристалізуються в інтервалі температур. Причому спочатку кристалізується один з компонентів. Тільки при певній концентрації елемента В відбувається сумісна кристалізація компонентів А і В і при цьому утворюється механічна суміш.
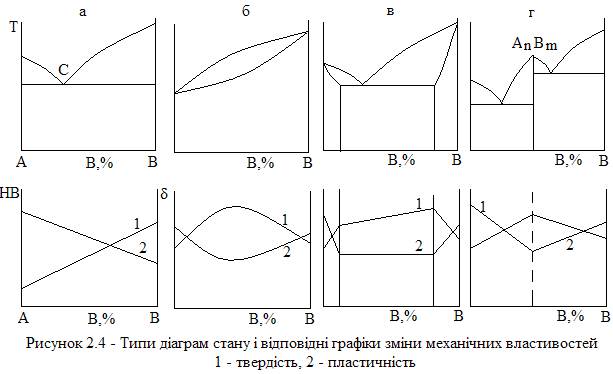
Діаграми стану другого типу (рис. 2.4 б) характерні для сплавів Cu-Ni, Co-Ni, Fe-Ni. У випадку повної розчинності компонентів в твердому стані кожний кристал будується одночасно атомами обох елементів і отримується сплав з кристалів твердого розчину. Температура кристалізації таких сплавів лежить між температурами кристалізації складових компонентів. Нахил ліній діаграми показує, що в процесі кристалізації відбувається зміна складу як рідкої, так і твердої фаз. Нижче лінії солідус розташовані кристали твердого розчину різної концентрації.
Діаграми стану сплавів третього типу (найбільш поширених) характерні для найважливіших промислових сплавів (Fe-C, Ni-Al, Fl-Cu). При кристалізації компонент В розміщується в решітці А з утворенням твердого розчину.
За діаграмами стану четвертого типу кристалізуються сплави Mg-Pb, Co-Sb, Mn-Si. В сплавах цієї системи після кристалізації при чітко визначеному співвідношенні компонентів утворюється хімічна сполука AnBm. Це відображується на діаграмі вертикальною лінією. Утворені хімічні сполуки відіграють роль самостійного компонента, який поділяє діаграму на ряд окремих діаграм.
3. Зв’язок діаграм стану з властивостями сплавів
Зв’язок між властивостями сплавів і типом діаграми встановлюється основними положеннями фізико-хімічного закону М. С. Курнакова. Згідно з цим законом існує відповідність між фазовим станом сплавів після кристалізації за характером зміни властивостей. Так, при утворенні необмежених твердих розчинів (рис. 2.4 б) властивості змінюються по криволінійному закону з максимумом або мінімумом. При утворенні механічної суміші (рис. 2.4 а) властивості змінюються по адитивному закону. Для сплавів, які розчиняються обмежено і утворюють евтектику (рис. 2.4 в), характер зміни властивостей у відповідності з фазовим станом у різних частинах діаграми має криволінійний і адитивний закони. В разі утворення при кристалізації хімічної сполуки (рис. 2.4 г) її складу відповідає максимум чи мінімум на графіках зміни властивостей.
Оскільки структура сплаву визначає його механічні та технологічні властивості, знання діаграми стану полегшує вибір конструкційного матеріалу для виконання конкретних деталей і допомагає застосувати раціональні методи їх обробки.
Беручи за основу діаграму стану можливо досить легко вирішити такі практичні задачі, як підбір сплавів для виготовлення деталей методом лиття чи штампування, визначити зварюваність матеріалів і т. ін..
Діаграми стану можуть бути також використані при виборі режимів термічної обробки.
Тема 3. Структура основних промислових сплавів
1. Залізовуглецеві сплави.
2. Структура сталей.
3. Структура чавунів.
1. Залізовуглецеві сплави
Залізовуглецеві сплави – сталі і чавуни – є найбільш розповсюдженими у сучасній промисловості. У рівноважному стані структури цих сплавів визначаються вмістом вуглецю та температурою і можуть бути описані діаграмою стану.
Довідка
Залізо (Fe) знаходиться у періодичній системі елементів в VI періоді, у восьмій групі під номером 26. Розповсюдженість у земній корі – 5,1 %. Перехідний метал. Температура плавлення чистого заліза (99,992 %) дорівнює 1539 °С, кипіння – 3200 °С. густина заліза – 7,874 г/см3, атомна маса – 55,85. Твердість технічного заліза близько 80 НВ, міцність σВ – 250 МПа. Залізо – пластичний метал.
Перетворення у твердому стані, що відбуваються у сплавах системи Fe-C, обумовлені поліморфізмом заліза. (в результаті поліморфного перетворення атоми кристалічного тіла, що мають решітку одного типу, перебудовуються таким чином, що утворюється кристалічна решітка іншого типу).
Залізо має поліморфні перетворення при 911 та 1392 °С. нижче температури 911 °С залізо має об’ємноцентровану кубічну решітку (ОЦК) і існує в α модифікації (Feα).
В інтервалі температур 911 – 1392 °С залізу притаманна гранецентрована кубічна решітка (ГЦК) і воно існує у γ модифікації (Feγ).
При температурі 1392 °С відбувається γ → α перетворення. Високотемпературна модифікація α-заліза називається δ-залізом.
Схема структурних перетворень заліза
| Температура, °С | модифікація | позначення | структура решітки |
| до 911 | α | Feα | ОЦК |
| 911 – 1392 | γ | Feγ | ГЦК |
| вище 1392 | α | Feδ | ОЦК |
У твердому стані залізо з вуглецем утворює три фази: ферит, аустеніт, цементит.
Ферит – твердий розчин вуглецю в Feα. Розчинність вуглецю в Feα невелика і складає 0,025 % при температурі 727 °С. із пониженням температури розчинність вуглецю в Feα зменшується і при кімнатній температурі складає 0,006 %. Ферит – твердий розчин проникнення обмеженої розчинності.
Аустеніт – твердий розчин вуглецю в Feγ. Максимальна розчинність вуглецю в Feγ при температурі 1147 °С складає 2,14 %. Із пониженням температури розчинність вуглецю зменшується і при 727 °С складає 0,8 %. Аустеніт – твердий розчин проникнення обмеженої розчинності.
Довідка
Аустеніт отримав назву на честь англійського металурга W. Roberts Austen (1843 – 1902 р.р.)
Цементит – хімічна сполука Fe3C (карбід заліза). При концентрації вуглецю 6,67 % залізо вступає в хімічну реакцію і утворюється Fe3C:
3Fe+C= Fe3C.
Властивості: ферит – м’який і пластичний, цементит – твердий і крихкий.
Три фази сплаву заліза з вуглецем
| Фаза | Позначення | Вміст С, % | Температура, °С | Структура |
| Ферит | Feα | 0,025-0,006 | 727-кімн. | твердий розчин обмеженої розчинності |
| Аустеніт | Feγ | 2,14-0,8 | 1147-727 | твердий розчин обмеженої розчинності |
| Цементит | Fe3C | 6,67 | 1260-кімн. | хімічна сполука |
Залізовуглецеві сплавиіз вмістом вуглецю ≤ 2,14 % називаються сталями. Залізовуглецеві сплавиіз вмістом вуглецю > 2,14 % називаються чавунами.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1569; Нарушение авторских прав?; Мы поможем в написании вашей работы!