
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатный процесс. Адиабатным называется процесс, протекающий при отсутствии теплообмена термодинамической системы с окружающей средой
|
|
|
|
Адиабатным называется процесс, протекающий при отсутствии теплообмена термодинамической системы с окружающей средой, необходимым условием адиабатного процесса является dq = 0 и q = 0.
Основное уравнение адиабатного процесса имеет вид
 , (5.17)
, (5.17)
где k – показатель адиабаты, определяемый из выражения (2.20).
Графиком адиабатного процесса в координатах Pv является неравнобокая гипербола 1 – 2 (рис. 24, а), а в координатах Ts – вертикальный отрезок 1 – 2 (рис. 24, б). Поскольку адиабатный процесс протекает при постоянной энтропии, его часто называют изоэнтропным процессом.

| 
|
| а) | б) |
| Рис. 24. Графики адиабатного процесса в координатах Pv (а) и Ts (б). |
Взаимное расположение адиабаты и изотермы в координатах Pv можно определить, проанализировав уравнения этих процессов. Так, уравнение изотермы (5.10) можно записать в виде
 .
.
Тогда по сравнению с уравнением адиабаты (5.17) отличие будет только в показателе степени при множителе v, в изотермическом процессе он равен единице, в адиабатном k > 1. Следовательно, в одном и том же интервале давлений от P 1 до P 2 изменение удельного объёма в изотермическом процессе будет больше, чем в адиабатном, т.е. в координатах Pv адиабата располагается всегда круче изотермы (рис. 25).

|
| Рис. 25. Взаимное расположение графиков адиабатного и изотермического процессов в координатах Pv. |
В рассмотренных выше процессах один из трёх параметров состояния, входящих в уравнение (1.20), оставался постоянным, и устанавливались соотношения между двумя оставшимися параметрами, которые подвергались изменению в процессе.
В адиабатном процессе изменяются все три параметра состояния системы – давление, удельный объём и температура, поэтому и соотношений между начальными и конечными параметрами состояния системы будет три пары.
Соотношение между давлением и удельным объёмом можно получить из уравнения адиабатного процесса (5.17), записав его в виде
 , (5.18)
, (5.18)
откуда, разделив переменные, получим
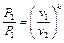 . (5.19)
. (5.19)
Для определения соотношения между остальными параметрами состояния системы в адиабатном процессе запишем уравнение состояния 1 кг идеального газа для точек 1 и 2:
 ,
, 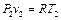 .
.
Разделив почленно второе выражение на первое, получим
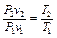 . (5.20)
. (5.20)
Заменив в выражении (5.20) отношение давлений отношением удельных объёмов из уравнения (5.19) и выполнив преобразования, получим соотношение между температурой и удельным объёмом в виде
 . (5.21)
. (5.21)
Заменив в выражении (5.20) отношение удельных объёмов отношением давлений из уравнения (5.19) и выполнив преобразования, получим соотношение между температурой и давлением:
 . (5.22)
. (5.22)
Работу расширения в адиабатном процессе определим на основании первого закона термодинамики (4.1) с учётом того, что q = 0:
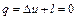 ,
,
откуда получим
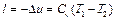 . (5.23)
. (5.23)
Из уравнений (2.18) и (2.20) можно получить
 . (5.24)
. (5.24)
Подставив в выражение (5.23) вместо Cv его значение из формулы (5.24), для работы расширения в адиабатном процессе получим
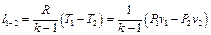 . (5.25)
. (5.25)
Полезная (располагаемая) работа l' в адиабатном процессе связана с работой расширения l следующим выражением:
 , (5.26)
, (5.26)
тогда из уравнения (5.25) с учётом равенства (5.26) получаем
 . (5.27)
. (5.27)
Изменение внутренней энергии Δ u и энтальпии Δ h в адиабатном процессе может быть найдено по общим формулам (1.10) и (1.13):
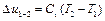 ,
,
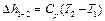 .
.
Изменения энтропии Δ s в адиабатном процессе не происходит, так как, как было отмечено ранее, адиабатный процесс является изоэнтропным, т.е. протекает при постоянной энтропии и
 .
.
Поскольку адиабатный процесс протекает без теплообмена с окружающей средой, следовательно,
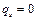 .
.
Тепловая схема адиабатного процесса приведена на рис. 26.

|
| Рис. 26. Тепловая схема адиабатного процесса. |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1339; Нарушение авторских прав?; Мы поможем в написании вашей работы!