
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Нестационарная теория теплового взрыва
|
|
|
|
Лекция
Эта теория была разработана Н.Н. Семеновым в 1940 г.
Рассмотрим простую систему. Пусть некоторый объем газа заключен в сосуд, стенки которого неизменно поддерживаются при заданной температуре То. Предположим, что при реакции температура внутри сосуда везде одинакова и равна Т. Ввиду этого вся разница температур между газом и стенкой сосредоточена на границе между ними. Соответственно этому внутри сосуда в газе не существует различия в концентрациях реагирующих веществ.
Напишем два выражения - для скорости выделения тепла во всем объеме V и для отдачи тепла через стенки сосуда. Если тепловой эффект реакции равен Q Дж/моль, то скорость выделения тепла в сосуде„ содержащей V объемов газа, равна
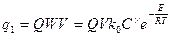 (2.28)
(2.28)
Это тепло идет частично на нагревание газа, частично теряется через стенки сосуда. Количество потерянного тепла запишем в виде
q2 =aF(T-To),
где F - общая поверхность стенок сосуда.
Предположение, что внутри сосуда температура однородна, означает, что скорость выравнивания температур там очень велика, так что основное термическое сопротивление оказывает тонкий слой газа, прилегающий к стенкам сосуда; понятно, что в этом случае величина a зависит как от формы и размеров сосуда, так и от температуры. Построим графики зависимости тепловыделения и теплоотвода от температуры (рис.2.3). Предположим, что до момента. воспламенения в сосуде не происходит изменения реагирующих веществ, т.о. концентрация постоянна и равна начальной Со. Система кривых 1,2,3 соответствует скорости выделения тепла для трех различных скоростей реакции (уравнение 2.21). Прямая 4 соответствует скорости отдачи тепла в зависимости от температуры внутри сосуда (2.29).
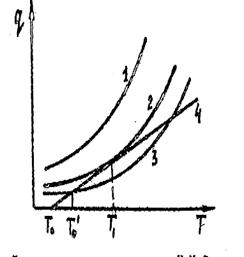
Рис.2.3. Диаграмма теплового взрыва Н.Н. Семенова: 1,2,3-тепловыделение;
4-теплоотвод
Когда реакция идет по кривой 3, то смесь будет разогреваться от Т0 до Т1, так как до этого момента теплоприход превышает теплоотвод. В точке Т1 нагрев прекратится. И система придет в равновесие. Реакция пойдет дальше с постоянной скоростью. Если количество реагирующих молекул не будет меняться, практически скорость будет падать.
В случае, когда реакция описывается кривой 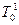 тепловыделение всегда превышает теплоотвод, и система с самого начала непрерывно наращивает температуру. Скорость реакции быстро возрастает, что ведет к явлению взрыва.
тепловыделение всегда превышает теплоотвод, и система с самого начала непрерывно наращивает температуру. Скорость реакции быстро возрастает, что ведет к явлению взрыва.
Существует, очевидно, определенное условие, характеризующее переход от ограниченного роста температуры к неограниченному. Это условие реализуется для кривой 2. В этом случае произойдет возрастание температуры газа до величины Т1.
Начиная с этого момента система находится в равновесии. Но если равновесие в точке Т1 для кривой 3 было устойчивым (повышение Т о только несколько изменяло Т1) то равновесие Т4 явно неустойчиво. Небольшие флуктуации температуры приводят к превышению теплоприхода над теплоотводом и к прогрессивному саморазогреву системы.
Условием перехода системы к воспламенению является условие касания кривой теплоотвода к кривой тепловыделения. В этой точке имеет место равенство скоростей тепловыделения и теплоотвода.
q1=q2 2.30),
и равенство скоростей изменения этих количеств с температурой
 (2.31)
(2.31)
Эти два условия однозначно определяют величину T1, характеризующую для данной системы предельное условие воспламенения, и температура T1 носит название температуры воспламенения или самовоспламенения горючей смеси. Найдем критические условия теплового взрыва, т.е. значения параметров системы на границе между двумя возможными режимами протекания процесса - стационарной медленной реакцией н взрывом.
Кинетика процесса описывается уравнением
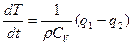 .
.
Представим его в безразмерном виде. Для этого, кроме безразмерного времени 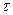 и температуры Q введем параметр
и температуры Q введем параметр  æ -- -критерий Н.Н. Семенова
æ -- -критерий Н.Н. Семенова
 æ =
æ = 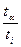 ,
,
где 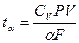 - характерное время теплоотвода;
- характерное время теплоотвода;
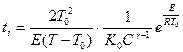 период индукции адиабатической реакции
период индукции адиабатической реакции
В этом случае уравнение (2.30) можно представить в следующем виде
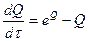 /æ (2.30).
/æ (2.30).
с печальными условиями 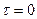 , Q=0.
, Q=0.
Решения уравнения (2.31) имеет вид (О.М.Тодес) /3/
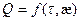 , æ =
, æ =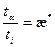 =const, (2.32)
=const, (2.32)
т.е. зависит oт одного безразмерного параметра, критическое значение которого необходимо определить. При достаточно больших æ характерной время теплоотдачи намного больше характерного времени тепловыделения, и тепло не успевает отводиться в стенки сосуда, должен произойти взрыв. В уравнении (2.31) это проявляется в том, что при достаточно больших æ. правая часть уравнения положительна при любых Q, т.е. уравнение
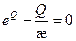 (2.33)
(2.33)
не имеет корней 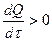 при всех t - температура смеси нeограниченно увеличивается. Если æ имеет такое значение, что корни уравнения (2.33) вещественны, то возможен стационарный режим - температура сначала возрастает, но только до такого значения, при котором
при всех t - температура смеси нeограниченно увеличивается. Если æ имеет такое значение, что корни уравнения (2.33) вещественны, то возможен стационарный режим - температура сначала возрастает, но только до такого значения, при котором 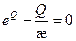 обращается в нуль, а далее реакция идет при постоянной температуре.
обращается в нуль, а далее реакция идет при постоянной температуре.
Условие теплового взрыва (рис.2.3) можно записать как условие касания функции expQ и Q/æ при некоторой температуре Q = Q*, а именно:
 ;
; 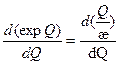 (2.34)
(2.34)
и в этом случае условия воспламенения принимают: вид
Q*=1; æ*=1/l (2.35).
Решение (2.35) можно записать так:
T* - T0 =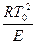 ;
;
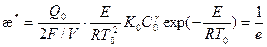 (2.36).
(2.36).
Существенным в теории Н.Н. Семенова является то, что к анализу нестационарного процесса применен стационарный подход, а именно: условия взрыва формулируется как условие исчезновения стационарного режиме (невозможность протекания медленной реакции с тепловыделением, уравновешенным теплообменом). Численные расчеты с высокой точностью подтверждают исходные предпосылки и выводы теории Н.Н. Семенова:
- предвзрывной разогрев равен (в пределах порядка) характеристическому интервалу 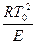 ;
;
- выгорание смеси за период индукции мало, и им можно пренебречь: 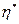 <<1.
<<1.
Из приведенных расчетов можно сделать еще один важный вывод. Прологарифмировав выражение (2.36), получаем:
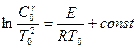 . (2.37)
. (2.37)
В частности, для бимолекулярной реакции в газовой фазе 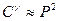 и тогда
и тогда
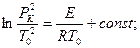 (2.38)
(2.38)
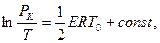
где через Pk обозначено давление, соответствующее критическому условию самовоспламенения.
Это соотношение, которое называется соотношением Н.Н. Семенова, устанавливает связь между Рк и То на границе, В системе координат Рк и То эта зависимость дает кривую, ограничивающую область взрыва (рис.2.4). Аналогичные зависимости можно установить между составом смеси и температурой при постоянном - давлении, а также между критическим давлением и составом смеси при постоянном значении Т1 (практически ~ТО).
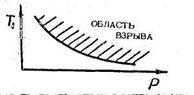
Рис.2.4. Зависимость температуры воспламенения Tj м давления Р при заданном постоянном начальном составе смеси
2.5. Тепловой взрыв в динамических условиях /4/
Рассмотренное случая соответствуют постоянству температуры стенки, равной начальной температуре смеси Тс = То=const. В работах А.Г. Мержанова с сотрудниками развита теория теплового взрыва в условиях линейного изменения To (нагрев и охлаждение), основанная на решении системы уравнений- (1.23)-(1.25), дополненных законом изменения температуры окружающей среда:
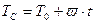 :, (2.39)
:, (2.39)
где 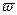 - скорость изменения температуры.
- скорость изменения температуры.
При нагреве (при To<<T*, где Т* - критическая температура теплового взрыва в статических условиях) система ведет себя сначала как инертное вещество, и температура в ней стационарно запаздывает по сравнению с Тс. В дальнейшем начинает проявляться тепловыделение от реакции, и запаздывание исчезает, а температура в системе обгоняет температуру в окружающей среде. Для реакции нулевого порядка тепловой взрыв неизбежен, В реальных системах из-за выгорания вещества существует критическое значение скорости нагрева 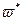 (при
(при 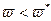 ) реакция протекает спокойно с небольшим перегревом, при
) реакция протекает спокойно с небольшим перегревом, при 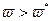 реакция завершается тепловым взрывом). Вблизи
реакция завершается тепловым взрывом). Вблизи 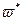 существует область квазистационарного протекания химической реакции, характеризующиеся большими глубинами предвзрывного превращения вещества
существует область квазистационарного протекания химической реакции, характеризующиеся большими глубинами предвзрывного превращения вещества 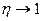 к вырождением самого теплового взрыва (рис.2.5).
к вырождением самого теплового взрыва (рис.2.5).
В динамических режимах вместо То удобно использовать критическую температуру Т*. Основным параметром динамической задачи является отношение характерных времен изменения температуры и химической реакции U:
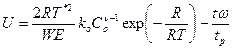 (2.40)
(2.40)
и представляет собой по существу динамический аналог критериев Н.Н. Семенова и Д.А. Франк - Каменецкого.

Рис. 2.5. Зависимость T (Ts) при различных значащих параметра U
2 .6. Вынужденное воспламенение (зажигание)
Под вынужденным воспламенением (зажиганием) понимают случаи воспламенения, когда основная масса горючей среды остается холодной, а нагревание производится только в одном небольшом по объему участке среды, газа в частности. Это может быть осуществлено разнообразными способами: введением в среду накаленного тела, небольшим пламенем, электрической искрой того или иного тала и так далее. С точки зрения физической сущности процесса вынужденного зажигания, нет принципиальных отличий от процесса самовоспламенения, поскольку условия самоускорения реакций в данном случае также существенны, но их действие пространственно ограничивается лишь частью объема горючей смеси. С точки зрения расчета, явление это более сложно, чем самовоспламенение.
Видимым и практически удобным критерием зажигания является факт распространения пламени от местного источника воспламенения на весь объем среды. Поэтому факторы, определяющие критические условия в случае зажигания, должны быть связаны, с одной стороны, со свойствами источника зажигания и, с другой- с условиями распространения горения, распространения пламени.
Для того, чтобы представить себе механизм зажигания от накаленного тела, рассмотрим высказанные в связи с этим соображения В. Вант-Гоффа.. Процессом диффузии пренебрегаем, считая, что концентрация реагирующих веществ везде одинакова и равна начальной. Предположим, что на поверхности тела произошло повышение температуры до некоторой величины Т1. В сpeде инертной, неспособной к реакции, распределение температура изобразится кривой T1А1 „ Для аналогичного процесса в реакционноспособной среде кривая температур должна быть уже несколько иной в силу дополнительного выделения тепла реакция,и ее можно изобразить примерно в вида пунктирной линии 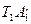 . Повысим теперь начальную температуру тела до Т2,.В инертной среде это поведет к возникновению распределения температуры Т2А2 подобного предыдущему с более резким ее спадом. В реагирующей среде; напротив; в силу увеличивающегося с повышением температуры выделения тепла, кривая температур будет падать медленнее, чем кривая
. Повысим теперь начальную температуру тела до Т2,.В инертной среде это поведет к возникновению распределения температуры Т2А2 подобного предыдущему с более резким ее спадом. В реагирующей среде; напротив; в силу увеличивающегося с повышением температуры выделения тепла, кривая температур будет падать медленнее, чем кривая 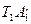 и можно предвидеть, что найдется такая температура Т2, при которой понижение температуры, по крайней мере вблизи источника, не произойдет, и кривая температур примет вид
и можно предвидеть, что найдется такая температура Т2, при которой понижение температуры, по крайней мере вблизи источника, не произойдет, и кривая температур примет вид 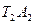 . Если после этого повысить начальную температуру источника, то стационарное состояние станет невозможным, так как температура в окружающей среде начнет прогрессивно возрастать по мере удаления от источника до тех пор, пока не произойдет воспламенения ( Т3-
. Если после этого повысить начальную температуру источника, то стационарное состояние станет невозможным, так как температура в окружающей среде начнет прогрессивно возрастать по мере удаления от источника до тех пор, пока не произойдет воспламенения ( Т3-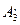 -В) (рис.2.6). Температура Т2 является для этих условий критической предельной температурой, т.е. температурой зажигания, и по своему смыслу аналогична температуре воспламенения в случае процессов самовоспламенения.
-В) (рис.2.6). Температура Т2 является для этих условий критической предельной температурой, т.е. температурой зажигания, и по своему смыслу аналогична температуре воспламенения в случае процессов самовоспламенения.
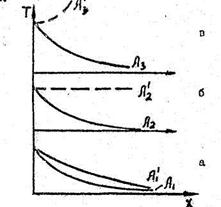
Рис. 2.5. Распределение температуры в процессе зажигания
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2453; Нарушение авторских прав?; Мы поможем в написании вашей работы!