
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон (начало) термодинамики
|
|
|
|
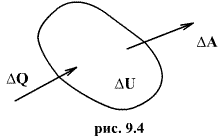
Первый закон термодинамики представляет собой закон сохранения энергии. Если сообщить телу количество тепла 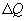 (рис.9.4), тело может за счет этого тепла увеличить свою внутреннюю энергию на величину
(рис.9.4), тело может за счет этого тепла увеличить свою внутреннюю энергию на величину 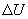 и, кроме того, выполнить работу
и, кроме того, выполнить работу 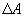 , причем в силу закона сохранения энергии: ΔQ=ΔU+ΔA
, причем в силу закона сохранения энергии: ΔQ=ΔU+ΔA
Последние выражение удобнее записать для малого изменения состояния системы, вызванного сообщением ей малого количества тепла δQ и совершением системой элементарной работы δA
| δQ = dU+ δA | (9.10) |
Различие в записи малого приращения внутренней энергии dU и элементарного количества теплоты δQ, а также элементарной работы δA объясняется следующим соображениями. Как уже отмечалось, внутренняя энергия системы являеться функцией ее состояния. Следоватено, при любом процессе, в результате которого система вновь возвратилась в некоторое состояние, полное изменение ее внутренней энергии равно нулю. Математически это записываться в виде уравнения 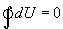 которое являеться необходимым и достаточным условием того, что внутренняя энергия системы U представляет собой, так называемый полный дифференциал dU. Работа и теплота такими свойствами не обладают. Поэтому δQ и δА не являються полными дифференциалами, эти величины являються “Функциями процесса” (см. рис. 9.3)
которое являеться необходимым и достаточным условием того, что внутренняя энергия системы U представляет собой, так называемый полный дифференциал dU. Работа и теплота такими свойствами не обладают. Поэтому δQ и δА не являються полными дифференциалами, эти величины являються “Функциями процесса” (см. рис. 9.3)
Таким образом:
δQ = dU+ δA
Первый закон термодинамики формулируеться следующим образом:
теплота, переданная системе, расходуеться на изменение ее внутренней энергии и на совершение работы.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 295; Нарушение авторских прав?; Мы поможем в написании вашей работы!