
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы О−Н
|
|
|
|
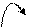 Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы О−Н. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. Распределение электронной плотности в карбоксильной группе можно представить следующей схемой:
Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы О−Н. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. Распределение электронной плотности в карбоксильной группе можно представить следующей схемой:
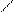
 δ+| O δ−
δ+| O δ−

 R — C→ C ..
R — C→ C ..
| O ← H δ+
Участие неподеленнй пары атома кислорода гидроксильной группы в сопряжении с электронами π-связи карбонильной группы значительно ослабляет связь О—Н в гидроксиле и облегчает отщепление атома водорода в виде протона (Н+). В водных растворах карбоновые кислоты обратимо диссоциируют:
R−COOH ↔ R−COO− + H+
Введение в углеводородный радикал акцепторных заместителей повышает, а донорных — понижает силу карбоновых кислот.
Карбоновые кислоты обладают всеми свойствами обычных кислот: они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот, например:
 2 CH3−COOH + Mg (CH3−COO)2Mg + H2↑
2 CH3−COOH + Mg (CH3−COO)2Mg + H2↑
ацетат магния
 CH3−CH2−COOH + NaOH CH3−CH2−COONa + H2O
CH3−CH2−COOH + NaOH CH3−CH2−COONa + H2O
пропионат натрия
При замещении группы −ОН в карбоксиле образуются различные функциональные производные кислот: сложные эфиры, ангидриды, галогенангидриды, амиды.
Реакция образования сложных эфиров:
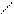
 O H2SO4 O
O H2SO4 O


 CH3−C + C2H5OH CH3−C + H2O
CH3−C + C2H5OH CH3−C + H2O
OH OC2H5
этиловый эфир уксусной кислоты
Образование галогенангидридов:

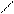

 O O
O O
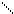

 3 CH3−C + PCl3 3 CH3−C + H3PO4
3 CH3−C + PCl3 3 CH3−C + H3PO4
OH Cl
хлорангидрид уксусной кислоты
Атом водорода при соседнем с карбоксильной группой атоме углерода способен замещаться на атомы галогенов:
 CH3−CH2−COOH + Br2 CH3−CHBr−COOH + HBr
CH3−CH2−COOH + Br2 CH3−CHBr−COOH + HBr
И, наконец, при сплавлении солей карбоновых кислот со щелочами происходит реакция декарбоксилирования; этой реакции способствует наличие в углеводородном радикале акцепторных заместителей:
t
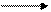 CH3−CH2−COONa + NaOH CH3−CH3 + Na2CO3
CH3−CH2−COONa + NaOH CH3−CH3 + Na2CO3
Муравьиная (метановая) кислота НСООН отличается от остальных рядом особенностей, поскольку является не только кислотой, но и альдегидом.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 554; Нарушение авторских прав?; Мы поможем в написании вашей работы!