
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализаторы и ингибиторы
|
|
|
|
Многие реакции можно ускорить или замедлить путем введения некоторых веществ. Добавляемые вещества не участвуют в реакции и не расходуются в ходе ее протекания, но оказывают существенное влияние на скорость реакции. Эти вещества изменяют механизм реакции (в том числе состав активированного комплекса) и понижают энергию активации, что обеспечивает ускорение химических реакций. Вещества – ускорители реакций называют катализаторами, а само явление такого ускорения реакции – катализом.
Многие реакции в отсутствие катализаторов протекают очень медленно или не протекают совсем. Одной из таких реакций является разложение пероксида водорода:
2Н2О2 = 2Н2О + О2.
Если опустить в сосуд с водным раствором пероксида водорода кусочек твердого диоксида марганца, то начнется бурное выделение кислорода. После удаления диоксида марганца реакция практически прекращается. Путем взвешивания нетрудно убедиться, что диоксид марганца в данном процессе не расходуется – он лишь катализирует реакцию.
В зависимости от того, в одинаковых или различных агрегатных состояниях находится катализатор и реагирующие вещества, различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор может ускорить реакцию путем образования промежуточных веществ за счет взаимодействия с одним из исходных реагентов. Например:

При гетерогенном катализе химическая реакция обычно протекает на поверхности катализатора:
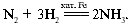
Катализаторы широко распространены в природе. Практически все превращения веществ в живых организмах протекают с участием органических катализаторов – ферментов.
Катализаторы используют в химическом производстве для ускорения тех или иных процессов. Кроме них применяют также вещества, замедляющие химические реакции, – ингибиторы. С помощью ингибиторов, в частности, защищают металлы от коррозии.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6000; Нарушение авторских прав?; Мы поможем в написании вашей работы!