
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитической диссоциации. Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия
|
|
|
|
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Химическое равновесие носит динамический характер. Например, в приведенной реакции HI постоянно образуется и расходуется. Если добавить в такую равновесную смесь радиоактивный йод, то он быстро распределяется между молекулами I2 и HI. Это говорит о постоянном переходе атомов йода из исходного вещества в продукт реакции и обратно.
Можно ли изменить состояние химического равновесия? Иными словами – можно ли сдвинуть равновесие в сторону образования продуктов или в сторону образования исходных веществ?
Ответ на этот вопрос подсказывают кинетические уравнения прямой и обратной реакций. Если добавлять в равновесную систему извне «лишний» водород, то возрастет величина молярной концентрации [H2] в кинетическом уравнении прямой реакции. Следовательно, увеличится скорость прямой реакции v пр, а скорость обратной реакции v обр останется неизменной. В итоге израсходуется какая-то часть добавленного водорода, а равновесие сместится вправо, т.е. в сторону образования продукта реакции. Такой же эффект даст и введение в систему дополнительных порций I2.
Напротив, добавление HI приведет к сдвигу равновесия влево. Это подтверждает кинетическое уравнение обратной реакции (v обр): она получит преимущество, поскольку возрастет величина [HI].
Мы можем заметить важную закономерность: при попытке воздействовать на равновесную систему она «сопротивляется» такому воздействию. Действительно, добавление в равновесную систему H2 или I2 приводит к увеличению их расходования в прямой реакции. В итоге H2 или I2 в системе окажется меньше, чем было добавлено, зато возрастет количество HI. Наоборот, добавление HI приводит к более быстрому его расходованию в обратной реакции. Такая способность равновесных систем «сопротивляться» внешним воздействиям носит общий характер и известна под названием принципа Ле Шателье:
Анри Луи Ле Шателье (1850-1936) – французский физикохимик, Президент Французского химического общества, член многих академий, в том числе Петербургской АН. Был почетным членом и АН СССР. Независимо от немецкого химика Ф. Габера в 1901 г. нашел условия синтеза аммиака.
Приведем пример реакции, в которой важным для положения равновесия фактором является давление. Она тоже происходит в газовой фазе:
2 NO2 (г)  N2O4 (г)
N2O4 (г)
При комнатной температуре NO2 – темно-коричневый газ (часто его называют «бурым» газом). Продукт его димеризации N2O4 бесцветен. Оба газа при обычных условиях присутствуют в смеси, т.е. находятся в химическом равновесии. Если увеличивать в такой равновесной химической системе давление, то равновесие сдвигается вправо – в сторону образования N2O4. Дело в том, что при одновременном увеличении концентрации [NO2] и [N2O4] преимущество получает прямая реакция. В ее кинетическое уравнение концентрация [NO2] входит в квадрате:
v пр = k1[NO2]2; v обр = k2[N2O4]
Происходящий при этом сдвиг равновесия вправо можно наблюдать экспериментально: при сжатии смеси газов она светлеет, поскольку уменьшается концентрация окрашенного NO2 и возрастает концентрация бесцветного N2O4 (рис. 1).

Рис. 1. При увеличении давления (Р2 > Р1) общее количество молекул в равновесной смеси уменьшается – система «сопротивляется» повышению давления: а) в системе больше молекул NO2 (смесь интенсивно окрашена); б) после увеличения давления молекул NO2 становится меньше (окраска ослабевает).
Но на равновесные реакции в растворах изменение давления не оказывает заметного влияния, если только в реакции не выделяется какой-нибудь газ. Дело в том, что жидкости почти не сжимаются под давлением, и концентрации растворенных в них реагирующих веществ практически не изменяются (если это не газообразные реагирующие вещества).
С помощью кинетических уравнений прямой и обратной реакций можно вывести закон действующих масс для химического равновесия. Пусть происходит обратимая реакция:

Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
v пр = k1[A]a[B]b; v обр = k2[C]c[D]d
При наступлении равновесия скорости прямой и обратной реакции становятся равны (v пр = v обр) и можно записать:
k1[A]a[B]b = k2[C]c[D]d
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:
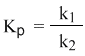
В предыдущем уравнении достаточно перенести в левую часть k2
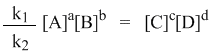
а из полученного уравнения уже легко получается выражение для константы равновесия Кр:

Это не что иное, как математическая запись закона действующих масс для химического равновесия. Например, для рассмотренной выше реакции
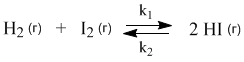

Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ.
До сих пор мы использовали кинетические уравнения для выяснения вопроса о сдвиге химического равновесия в ту или иную сторону. И хотя далеко не для всех реакций их кинетические уравнения соответствуют химическим уравнениям, качественно определить направление смещения равновесия таким способом удается. Например, для сложной гетерогенной химической реакции
Fe3O4 (тв) + СО (г)  3 FeO (тв) + СО2 (г) + Q кДж
3 FeO (тв) + СО2 (г) + Q кДж
можно предсказать, что изменение давления не приведет к смещению равновесия. Здесь скорости прямой и обратной реакции зависят в основном от концентраций газов (которые при изменении давления меняются одинаково), а твердые вещества не входят в кинетические уравнения.
v пр = k1[CO]; v обр = k2[CO2]
Теплоту тоже можно рассматривать как «продукт» реакции. Следовательно, нагревание такой равновесной смеси должно приводить к активизации обратной реакции и смещению равновесия влево – в сторону образования исходных Fe3O4 и CO.
Наоборот, отведение образующегося тепла (понижение температуры) будет уменьшать скорость обратной реакции и равновесие сдвинется вправо – в сторону продуктов FeO и CO2.
Можно не пользоваться для решения таких вопросов кинетическими уравнениями, а прямо применить принцип Ле Шателье. Действительно, при нагревании равновесной системы с оксидами железа она должна сопротивляться этому воздействию – то есть замедлять прямую реакцию, идущую с выделением тепла. Точно так же (без кинетических уравнений) можно решать вопрос о смещении равновесия при увеличении давления в системе
2 NO2 (г)  N2O4 (г)
N2O4 (г)
Для того, чтобы «сопротивляться» увеличению давления, эта система должна активизировать реакцию, приводящую к уменьшению общего числа молекул в смеси. Такой реакцией является прямая реакция, в которой из двух молекул газа получается одна. Следовательно, преимущество получит прямая реакция и равновесие сдвинется вправо.
Способы смещения химического равновесия играют большую роль в химической промышленности. Например, синтез аммиака является обратимой, экзотермической, каталитической реакцией:

Во всех рассмотренных до сих пор реакциях, кроме синтеза аммиака, кинетические уравнения прямых и обратных реакций соответствовали их химическим уравнениям. Но получение аммиака и обратная реакция его разложения – это сложные, многостадийные процессы, состоящие на самом деле из нескольких элементарных стадий. Поэтому выражение для константы равновесия в синтезе аммиака нельзя записать на основании формального закона действующих масс. Выражение для Кр в таких случаях можно получить, только опираясь на экспериментальные данные.
Однако принцип Ле Шателье позволяет качественно подобрать условия, наиболее подходящие для сдвига равновесия вправо, т.е. в сторону максимально возможного содержания аммиака в равновесной смеси. Это имеет большое практическое значение – ведь чем больше равновесие сдвинуто вправо, тем больше аммиака можно получать в промышленной установке.
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию концентрации газов – для этого активизируется прямая реакция превращения четырех молекул газа (одной молекулы азота и трех водорода) в две молекулы газообразного аммиака. Во-вторых, необходимо отводить образующееся в реакции теплоту, т.е. понижать температуру. Если температуру повышать, то обратная реакция ускорится в большей степени, поскольку она идет с поглощением теплоты. Однако если охлаждать реактор слишком сильно, то обе реакции замедляются и равновесие устанавливается слишком медленно.
В промышленности находят компромисс – давление в аппаратах синтеза аммиака держат настолько высоким, насколько может выдержать их конструкция, а температуру выбирают средней, при которой равновесие в системе наступает достаточно быстро и в то же время не слишком сильно смещено в сторону исходных веществ – азота и водорода. Этой же цели служит и железный катализатор – он ускоряет наступление химического равновесия. Как вы уже знаете, катализаторы одинаково хорошо ускоряют как прямую, так и обратную реакции, поэтому добавление катализатора не может изменить положение равновесия, но способствует более быстрому его достижению.
Промышленное получение аммиака из атмосферного азота имеет огромное значение для современной цивилизации. Азот – весьма инертное вещество и его соединения в виде полезных ископаемых (селитр) встречаются очень редко. В то же время растения нуждаются в азоте, поэтому современное сельское хозяйство требует интенсивного применения все большего количества азотных удобрений, которые делают на основе аммиака. Также аммиак служит сырьем для производства азотной кислоты, а уже с участием HNO3 осуществляются многие другие важнейшие промышленные процессы – от получения лекарств и взрывчатых веществ до переработки ядерного топлива.
Вопросы для закрепления темы:
1. Какие вы знаете типы реакций?
2. Что называется обратимой реакцией?
3. Что называется химическим равновесием?
4. Почему химическое равновесие называется динамическим?
5. Чем определяется константа равновесия?
6. В чем суть принципа Ле Шателье?
7. Какую роль играют способы смещения равновесия в промышленности?
8. В каких системах влияет изменение давления на смещение равновесия?
9. Какие реакции называются эндотермическими?
10. Какие реакции называются экзотермическими?
Лекция № 7: Общие сведения о растворах. Электролитическая диссоциация.
Смеси нескольких веществ, без химического взаимодействия между ними называют раствором. В металлургии и материаловедении растворы металлов друг в друге, находящиеся в твердом состоянии, принято называть сплавами. Поскольку соотношения компонентов в растворе - их концентрации - могут меняться в некотором диапазоне, то растворы называют также фазами переменного состава.
Если одного из веществ в смеси значительно больше, чем других, то говорят о растворе остальных веществ в этом преобладающем веществе - растворителе. Для растворов твердых веществ (твердых растворов), особенно в материаловедении и металлургии, растворитель носит название матрицы. Все остальные вещества, кроме основного - растворителя или матрицы - называются примесями. Если вещество внесено в раствор специально, до определенного уровня и с целью изменить свойства матрицы, повлиять на свойства раствора, то такое вещество называют легирующей примесью или лигатурой. Количественная характеристика вещества, учитывающая весь состав раствора, называется концентрацией.
В газах и жидкостях образующие их атомы или молекулы подвижны и не имеют четкого (во времени) местоположения. Их механические смеси носят единственное название - растворы. Это утверждение справедливо и для аморфных веществ.
Для твердых веществ, имеющих кристаллическую структуру, т.е. постоянное во времени пространственное расположение атомов, понятие раствора - твердого раствора - усложняется.
Простейший вариант твердого раствора - это когда все компоненты раствора являются твердыми веществами и имеют одинаковую сингонию, причем параметры решеток всех веществ близки друг к другу. При образовании раствора из таких компонентов атомы растворяемого вещества располагаются в узлах решетки основного, т.е. замещают позиции атомов матрицы. Такие твердые растворы называются твердыми растворами замещения.
Если вещество, входящее в твердый раствор, имеет существенно меньший размер от атомов основного компонента - растворителя, то его атомы могут располагаться между узлами решетки - внедряться между ними. Такие твердые растворы носят название твердых растворов внедрения. Очень часто растворами внедрения оказываются растворы таких веществ, которые не является твердыми при обсуждаемых условиях. К ним, прежде всего, относятся газы (кислород, азот, водород и др.). Практически во всех металлах углерод при малых концентрациях также образует твердый раствор внедрения. Понятно, что, при внедрении атома в кристаллическую решетку и установка его на межузельную позицию, он попадает в силовое поле атомов матрицы, заведомо отличающееся от поля межатомного взаимодействия чистого внедряющегося вещества. Появление лишнего атома на несвойственном для матрицы месте вызывает силовое воздействие и на основное вещество-растворитель. Термодинамические свойства индивидуальных веществ - компонентов раствора - при этом существенно меняются. Поэтому во всех конкретных случаях твердого раствора внедрения нужен свой, индивидуальный подход к количественному описанию каждого реального раствора.
К классу растворов относят также вариант химического соединения, в узлах кристаллической решетки которого недостает атомов - они или не заняли свое место при образовании кристаллита, или покинули его (например, испарились) в последующий период. Этот вариант называют твердым раствором вычитания по недостающим атомам. Узел решетки, в котором отсутствует атом, называется вакансией. Твердый раствор вычитания потому и может называется раствором, поскольку его можно формально представить как раствор с замещением атомов матрицы на вакансии - квазичастицы некоего виртуального вещества. Его термодинамическое описание также требует индивидуального подхода для каждого реального случая раствора.
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты -проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2SO4 и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl).
К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза.
Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении.
Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.
Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус.Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
Схема электролитической диссоциации.

Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности
Уравнение диссоциации можно записать следующим образом:
NaCl  Na+ + Cl- Na+ + Cl-
|
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 805; Нарушение авторских прав?; Мы поможем в написании вашей работы!