
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора
Понятие о буферных растворах.
Способность раствора поддерживать определенное значение рН называется буферным действием, а растворы, обладающие таким свойством, называются буферными.
Буферное действие раствора измеряется буферной емкостью, т.е. тем количеством щелочи или кислоты, которое требуется прибавить к 1 л раствора, чтобы значение его рН изменилось на единицу.
Наиболее эффективные буферные растворы готовят из растворов слабой кислоты и ее соли или слабого основания и его соли. Ацетатный буферный раствор представляет собой раствор уксусной кислоты СН3СООН и ацетата натрия NаСН3СОО. Аммиачный буферный раствор представляет собой раствор гидроксида аммония NH4OH и хлорида аммония NH4Cl.
Буферное действие подобных растворов основано на следующих процессах. Если к ацетатному буферному раствору [СН3СООН + NаСН3СОО] прибавить в пределах буферной емкости раствор щелочи (NaOH или КОН), то будет происходить нейтрализация гидроксида слабой кислотой:
СН3СООН + ОН– = СН3СОО– + Н2О.
При добавлении к ацетатному буферному раствору сильной кислоты ионы водорода связываются анионами слабой кислоты, образующейся при диссоциации соли:
Н+ + СН3СОО– = СН3СООН.
Таким образом, в результате связывания гидроксид-ионов или ионов водорода, возникающих при добавлении сильного основания или сильной кислоты, рН буферного раствора практически не изменяется. Так, при добавлении в 1 л 0,1М ацетатного буферного раствора, а для сравнения и в воду 0,01 моль соляной кислоты или гидроксида натрия рН растворов принимает значения, приведенные ниже.
| Добавленное вещество | Значение рН | |
| воды | ацетатного буферного раствора | |
| – | 4,65 | |
| 0,01 моль HCl | 4,56 | |
| 0,01 моль NaOH | 4,73 |
Из этих данных видно, что при добавлении кислоты или щелочи к воде рН полученного раствора изменяется на пять единиц, а добавление такого же количества кислоты или щелочи в ацетатный буферный раствор изменяет рН в пределах 0,1 единицы.
Аналогично действие аммиачного (аммиачно-аммонийного) буферного раствора [NH4OH + NH4Cl] при введении кислоты или щелочи, обусловленное протеканием следующих процессов:
NH4OH + Н+ =  + Н2О,
+ Н2О,
 + ОН- = NH4OH.
+ ОН- = NH4OH.
Как рассчитать рН буферного раствора, вы знаете: вспомните о смещении равновесия диссоциации уксусной кислоты одноименным ионом – добавлением в раствор ацетата натрия. Именно тогда вы получили буферный раствор!
Буферные растворы могут быть приготовлены также из кислоты и ее кислотной соли, из двух кислотных солей, а также из соли, подвергающейся гидролизу, и другой кислотной соли. К таким буферным растворам относятся растворы фосфорной кислоты и ее солей:
| [Н3РО4 + NaН2РО4], | рН < 7; |
| [NaН2РО4 + Na2НРО4], | рН  7; 7;
|
| [Na2НРО4 + Na3РО4], | рН > 7. |
Буферные растворы – фосфатный [ +
+  ] и карбонатный [
] и карбонатный [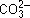 +
+ 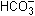 ] – имеют большое значение для обеспечения жизнедеятельности организмов, т.к. они поддерживают постоянство рН физиологических жидкостей. Кроме этих буферных растворов рН крови и других жидкостей организма сохраняется постоянным благодаря белкам и гемоглобину. У человека рН крови равен 7,35–7,45. На 75% буферная емкость крови обусловлена гемоглобином. Она настолько велика, что требуется в 50 раз больше сильной кислоты или щелочи, чтобы изменить рН на ту же величину по сравнению с водой.
] – имеют большое значение для обеспечения жизнедеятельности организмов, т.к. они поддерживают постоянство рН физиологических жидкостей. Кроме этих буферных растворов рН крови и других жидкостей организма сохраняется постоянным благодаря белкам и гемоглобину. У человека рН крови равен 7,35–7,45. На 75% буферная емкость крови обусловлена гемоглобином. Она настолько велика, что требуется в 50 раз больше сильной кислоты или щелочи, чтобы изменить рН на ту же величину по сравнению с водой.
|
|
Дата добавления: 2014-01-07; Просмотров: 1602; Нарушение авторских прав?; Мы поможем в написании вашей работы!