
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация комплексных соединений и ионов
|
|
|
|
Система названий комплексных соединений
Название комплексного соединения зависит от того, катионом или анионом является внутренняя сфера.
Число лигандов каждого вида обозначается греческими числительными:
1-моно,
2-ди,
3-три,
4-тетра,
5-пента,
6- гекса.
Названия наиболее распространенных лигандов:
NH3-аммин,
Н2О-аква,
Сl- - хлоро,
NO2--нитрито,
CN- -циано,
S2O32--тиосульфато.
Если комплексный ион является катионом, то название соединения формируется следующим образом:
1. Анион внешней сферы.
2. Катион внутренней сферы:
· координационное число,
· лиганды,
· комплексообразователь (русское название элемента в родительном падеже),
· заряд комплексообразователя.
Отсюда:
[H(NH3)]Cl – хлорид диаммин водорода (1),
[Cu(NH3)4](OH)2 – гидроксид тетрааммин меди (2).
Если комплексный ион является анионом, то название соединения формируется следующим образом:
1. Комплексный анион:
· координационное число,
· лиганды,
· комплексообразователь (латинское название элемента, в котором окончание "ум" заменено на окончание "ат",
· заряд комплексообразователя.
2. Катион внешней сферы.
Например:
К3[BiI4] – тетраиодовисмутат (3) калия.
Между ионом внешней и внутренней сфер возникает ионная связь, поэтому комплексные соединения диссоциируют на ионы необратимо:
K3[Fe(CN)6]=3K++[Fe(CN)6]3-.
Между комплексообразователем и лигандами возникает донорно-акцепторная связь (комплексообразователь – акцептор, лиганды – доноры), поэтому комплексный ион диссоциирует как слабый электролит:
[Fe(CN)6]3-  Fe3+ +6CN-
Fe3+ +6CN-
Диссоциация комплексных ионов имеет количественную характеристику – константу нестойкости (Кн):
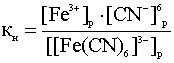
В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.
| Кнест | 10-1÷10-3 | 10--4÷10-20 | <10-20 |
| Устойчивость ком. ионов | Нестойкие | Устойчивые | Очень устойчивые |
| Способ разрушения | Разбавлением раствора | Химическим воздействием на лиганды | Практически неразрушимы |
Чтобы разрушить комплексный ион, необходимо сместить его равновесие в прямом направлении.
Так как при разбавлении растворов диссоциация усиливается, для разрушения неустойчивых комплексных ионов достаточно разбавить раствор водой.
Устойчивые комплексные ионы разрушают химическим воздействием, либо на комплексообразователь, либо на лиганды.
Это означает, что или комплексообразователь, или лиганды надо удалить из раствора в виде более труднорастворимого соединения, чем разрушаемый комплексный ион.
Например, надо разрушить устойчивый ион
[Ag(NH3)2]+, имеющий Кн = 10-8.
Если на раствор, содержащий данный ион, воздействовать раствором иодида калия, то ионы серебра будут удалены из раствора в виде AgI, имеющего произведение растворимости, равное 10-17.
Если воздействовать азотной кислотой, то лиганды, молекулы NH3, будут связаны в комплексный ион [H(NH3)]+, константа нестойкости которого равна 10-14.
В обоих случаях понизится концентрация продуктов реакции:
[Ag(NH3)2]+  Ag+ +2NH3
Ag+ +2NH3
и по принципу Ле Шателье равновесие реакции сместится в прямом направлении, в сторону разрушения комплексного иона.
Процессы комплексообразователя широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант нестойкости образуемых ими комплексных соединений.
Классификация комплексных соединений
Комплексные соединения подразделяются на электролиты и неэлектолиты.
Комплексные неэлектролиты:
| [Fe(SCN)3]0 – | тритиоциано железа (3); |
| [Cr(H2O)3Cl3]0 – | триакватрихлоро хрома (3). |
Последнее соединение называется неоднородным комплексным соединением, так как комплексообразователь координирует вокруг себя различные лиганды.
| Комплексообразователь | Заряд | Координационное число |
| Сr |
Комплексные электролиты подразделяются на кислоты, гидроксиды и соли.
H[AuCl3] - трихлорозолотая кислота.
H2[PtCl6] - гексахлороплатиновая кислота.
[Cu(NH3)4](OH)2- гидроксид тетрааммин меди (2).
[Ni(NH3)6]SO4- сульфат гексааммин никеля (2).
Комплексные соединения классифицируются по виду лигандов.
Если лигандами служат молекулы аммиака, комплексные соединения называются аминокомплексами.
Если лигандами служат молекулы H2O, то комплексные соединения называются аквакомплексами.
Если лиганды - ОН, то комплексные соединения называются гидрокомплексами.
Если лигандами служат любые кислотные остатки, то комплексные соединения называются ацидокомплексами.
Применение комплексных соединений
- Из комплексных соединений добывают металлы, используемые для нанесения покрытий.
- Многие металлы, особенно тяжелые, образуют с органическими соединениями комплексоны, т.е. происходит связывание токсичных металлов в комплексоны, что приводит к понижению их концентрации. Это используется для отчистки загрязненной воды и для производства лекарств, которые выводят тяжелые металлы из организма.
- Первые вещества, отнесенные к комплексным, использовались берлинским цехом художников как краски – турнбулева синь и берлинская лазурь. Сегодня эти вещества используют в аналитической химии как реагенты на ионы Fe2+ и Fe3+.
- Гемоглобин и хлорофилл, без которых невозможно представить жизнь на Земле, – это тоже комплексные соединения.
- На процессах комплексообразования основано отделение золота от пустой породы.
- Фотографический процесс также немыслим без комплексных соединений
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 7825; Нарушение авторских прав?; Мы поможем в написании вашей работы!