
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физический смысл степени превращения: теоретический выход продукта реакции по данному исходному веществу
|
|
|
|
Использование мольных единиц измерения количества веществ позволяет просто описывать реакции, происходящие между ними - с помощью закона стехиометрических соотношений. Практическим его выражением являются стехиометрические уравнения.
Стехиометрическое уравнение - соотношение, ycтанавливающее мольные пропорции, в которых реагируют химические вещества с образованием продукта реакции.
Стехиометрические коэффициенты - коэффициенты, стоящие перед химической формулой данного химического вещества в стехиометрическом уравнении и показывающие его количество в молях.
Например, для реакции полимеризации мономера М, инициированной инициатором I с образованием полимера, содержащего n звеньев мономера в одной макромолекуле, стехиометрическое уравнение имеет вид:
nМ + mI = Mn Im,
а для поликонденсации эквимолярной смеси двух бифункциональных мономеров М1 и М2, протекающей с выделением низкомолекуляронгo продукта L:
nМ1 + nМ2 = (М1 M 2)n + (n-l)L.
В случае сложных реакционных систем, с участием многих веществ, система стехиометрических уравнений может быть очень большой, не имеющим простого решения. Для упрощения выделяют ключевые уравнения.
Для характеристики количественного состава реакционной смеси необходимо знать количества ключевых веществ. Ключевыми являются вещества, количества которых однозначно определяют состав реакционной системы.
Балансовые соотношения при полимеризации
Уравнение материального баланса - уравнение, устанавливающее взаимосвязь между начальным и конечным (после реакции) составом реакционной смеси. Уравнения материального баланса по конкретным веществам устанавливают взаимосвязь для каждого из них с учетом степени их превращения в ходе реакции.
Наиболее общая схема процессов цепной полимеризации может быть представлена в виде последовательности стадий, состоящих из элементарных реакций:
• стадия зарождения цепи, включающая в себя разложение молекулы инициатора I и образование реакционного центра реакцией осколка инициатора с молекулой мономера IM.
• стадия роста цепи IMMM
• стадия обрыва цепи рекомбинацией и/или диспропорционированием активных макромолекул
IMp + IMq
Стехиометрия реакции полимеризации реакции полимеризации:
nМ + mI = Mn Im, где n, m - стехиометрические коэффициенты определяемые как:
m= (R+1)/ s, где
s - число активных частиц, образующихся при распаде инициирующего вещества,
R - изменение числа молей в реакции обрыва цепи.
Обычно в инициируемой инициаторами радикальной цепной полимеризации s = 2, но в ряде случаев s = 1. Это, например, имеет место при инициировании смесями пероксидов с солями металлов пере мен ной валентности или с третичными аминами.
R принимает значения 0 (нуль) в случае обрыва цепи по реакции диспропорционирования и 1 - в случае рекомбинации.
Таким образом, реакция полимеризации оказывается стехиометрически простой, и для ее описания достаточно знать количество (концентрацию) одного ключевого вещества, в качестве которого обычно принимается мономер.
Наиболее распространенная радикальная цепная полимеризация инициируется инициаторами, которые при термическом распаде дают два активных осколка, т.е. S = 2.
Под n подразумевается среднечисловая степень полимеризации P, которая легко определяется из мольных материальных балансов по исходному веществе (мономеру) и инициатору:
Р= (Nom - Nm)/ (NI0 - NI) * κ, где
N0m и N0I количество мономера и инициатора (в молях) в начальный момент времени
Nm и NI количество мономера и инициатора (в молях) в текущий момент времени t. соответственно.
κ – коэффициент, зависящий от доли обрыва цепи (λ) = от 0 до 1, и числа активных частиц, образующихся при распаде инициирующего вещества (s), и определяемый как:
κ = (1+λ)/s
Физический смысл полученного уравнения очевиден: содержание молекул мономера в одной молекуле полимера есть молярное отношение количества превращенного мономера к количеству превращенного инициатора, т.е. к количеству активных центров, на которых протекал процесс полимеризации. Множитель перед этим отношением представляет собой поправку на число активных центров, образующихся при распаде одной молекулы инициатора, и характер образования неактивной макромолекулы (рекомбинацией или диспропорционированием). Таким образом, значение средней степени полимеризации зависит от типа реакций зарождения и обрыва физической цепи роста макромолекул.
Уравнение является основой для материальных расчетов процессов полимеризации по заданной степени полимеризации (средней молекулярной массе полимера), однако в реальных балансах необходимо учитывать чистоту реагентов, степень их превращения и неизбежные технологические потери, а также эффективность использования инициатора.
Балансовые соотношения при поликонденсации (полиприсоединении)
Стехиометрические соотношения в поликонденсации более сложны по сравнению с полимеризацией из-за большего количecтва и большого разнообразия мономеров различной функциональности. Основой для их описания является то, что в эквимолярных количествах в общем случае реагируют функциональные группы, а не молекулы мономеров. Важным следствием этого является различие понятий концентраций функциональных групп (Сf) и мономеров (М). Отсюда следует важный вывод: совпадение степени превращения разных функциональных групп и степени превращения мономеров имеет место только в том случае, когда функциональности мономеров равны, в ином случае степени превращения не будут совпадать.
Наиболее просто описываются стехиометрические соотношения в процессах поликонденсации соединений, содержащих способные к взаимодействию друг с другом группы в одной и той же молекуле. Это относится, например, к поликонденсации олигомерных полиметиленгликолей
НО(СН2)nОН и т.п. Иногда такие процессы называют линейной гомополиконденсацией. Стехиометрическое уравнение для них очевидно:
n(НО (СН2)ОН) = НО (СН2)nОН + (n - l) Z,
где р и q - реагирующие функциональные группы, а Z – низкомолекулярный побочный продукт.
Материальный баланс по мономеру имеет вид:
[M]0=[M] + Σ n[Mn ] + Σ (n-1)Z,
Сложение по n идет от 1 до ∞. Причем последний член в правой части учитывается только в процессах поликонденсации.
Из формулы следует, что в поликонденсации и полиприсоединении концентрация полимера в ходе реакции не изменяется, а растет лишь его средняя степень поликонденсации (присоединения). Мономер здесь рассматривается как полимер со степенью поликонденсации единица.
Действительно, при достаточно больших степенях поликонденсации суммарной концентрацией олигомеров можно пренебречь по сравнению с остаточной концентрацией мономера.
Определение средней степени поликонденсации
P = [M]0 /[M]
Таким образом, степень превращения мономера является единственным параметром, контролирующим как временной ход процесса, так и параметры образующегося продукта.
Молекурярно-массовое распределение (ММР)
К числу наиболее важных характеристик полимеров, зависящих от технологии синтеза, относятся:
• величина средней степени полимеризации (средней молекулярной массы) и рассеяние (дисперсия) вокруг нее (степень полидисперсности);
• величина (степень) разветвленности;
• степень упорядоченности распределения мономерных звеньев в макромолекуле (чередующиеся, статистические, привитые, блоксополимеры, смеси (сплавы) гомополимеров и т.п.) для продуктов совместной полимеризации нескольких мономеров (сополимеров).
Принятой мерой среднего размера макромолекулы является средняя степень полимеризации (Р), показывающая усредненное по всей смеси по определенному признаку число звеньев мономера, содержащееся в одной молекуле полимера. Для полимеров различают среднечисловую, среднемассовую и среднеседиментационную степень полимеризации. Среднемассовая степень полимеризации - степень полимеризации, усредненная по массе макромолекул данного размера. Среднечисловая степень полимеризации - степень полимеризации, усредненная по числу макромолекул данной длины. Величина степени полимеризации совпадает с наиболее вероятным средним значением числа звеньев мономера в одной макромолекуле.
Вторым параметром ММР является мера рассеяния значений этой величины вокруг среднего, или ее дисперсия. Наглядно типичные кривые молекулярно-массового распределения показаны на Рис.1: унимодальное нормально логарифмическое (сплошная кривая), унимодальное наиболее вероятное биномиальное (пунктирная), бимодальное (штриховая).
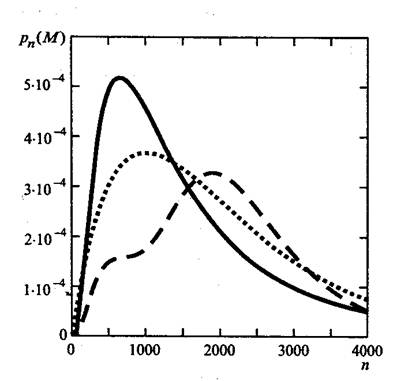
Рис. 1. Унимодальное нормально логарифмическое (сплошная кривая), унимодальное наиболее вероятное биномиальное (пунктирная), бимодальное (штриховая) ММР.
В технологии линейных полимеров степень ветвления чаще оценивается числом ветвлений на 1000 атомов углерода основной цепи. Например, в ПЭВД на каждые 1000 атомов основной цепи приходится 30-50 ответвлений в виде от этильных до гексильных групп, в ПЭНД их меньше 8, а в ПЭСД меньше 5.
Получение оценок значений средних молекулярных масс полимеров производится экспериментально путем измерения свойств их растворов в растворителях. Свойства растворов, пропорциональные числу растворенных молекул, такие, как понижение температуры замерзания раствора полимера (метод криоскопии), повышение температуры его кипения (метод эбулиоскопии), изменение осмотического давления (метод осмометрии) - дают возможность оценки среднечисловых молекулярных масс. Свойства растворов, зависящие от массы (объема) макромолекул, такие как рассеяние света, диффузионные и др., позволяют оценить значения среднемассовых молекулярных масс.
Широко распространенные (вследствие простоты определения) средневязкостные молекулярные массы Mη, которые дают средние значение между среднечисловыми и среднемассовыми значения.
Во всех случаях используются эмпирические зависимости между молекулярными массами и свойствами растворов.
Например, для оценки значения средневязкостных молекулярных масс применяется степенное уравнение Марка- Хувинка-Флори для так называемой характеристической вязкости [η]:
[η]=KMηα , где К и α – эмпирические табличные константы.
[η]= lim ηуд/с, где ηуд- удельная вязкость (отношение вязкости раствора полимера к вязкости чистого растворителя, а с – концентрация.
Наиболее эффективным способом измерения ММР является метод гель-проникающей хроматографии. Он основывается на хроматографировании раствора полимера на пористом носителе с различными размерами пор подходящим растворителе и детекторным определением каких-либо свойств раствора на выходе из колонки, пропорциональных молекулярной массе растворенного полимера.
Более надежные сведения о ММР дает только кривая ММР. Последнюю можно получить методами фракционирования образца полимера на достаточно узкие по молекулярной массе фракции и последующего определения их средней молекулярной массы одним из описанных выше методов. Применяются методы дробного осаждения полимеров из их растворов.
Термодинамика
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 976; Нарушение авторских прав?; Мы поможем в написании вашей работы!