
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение первого начала термодинамики к изопроцессам
|
|
|
|
Будем рассматривать квазиравновесные процессы, т.е. такие, которые идут настолько медленно, что характерное время установления внутреннего равновесия 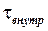 много меньше времени наблюдения за протекающим процессом
много меньше времени наблюдения за протекающим процессом 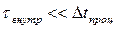 . К таким процессам может быть применено первое начало термодинамики. Проанализируем с этой точки зрения квазиравновесные процессы в идеальном газе, то есть процессы в системах, уравнением состояния которых является уравнение Менделеева-Клапейрона.
. К таким процессам может быть применено первое начало термодинамики. Проанализируем с этой точки зрения квазиравновесные процессы в идеальном газе, то есть процессы в системах, уравнением состояния которых является уравнение Менделеева-Клапейрона.
Пусть процесс идет без теплообмена с окружающей средой, то есть система является адиабатически изолированной. Процессы происходящие в такой системе, называются адиабатными процессами, при этом 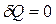 . Для обеспечения этого условия процесс должен идти быстро. Противоречит ли это условию квазиравновесности процесса? Введем время установления равновесия системы с окружающей средой
. Для обеспечения этого условия процесс должен идти быстро. Противоречит ли это условию квазиравновесности процесса? Введем время установления равновесия системы с окружающей средой  . О квазиравновесном адиабатном процессе можно говорить, только когда
. О квазиравновесном адиабатном процессе можно говорить, только когда 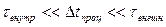 .
.
Предположим, что рассматриваемый процесс удовлетворяет указанному условию и, следовательно, к его анализу применимо первое начало термодинамики, которое в данном случае принимает вид
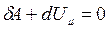 , (3.3.1)
, (3.3.1)
т.е. при адиабатном процессе работа совершается системой за счет убыли ее внутренней энергии, то
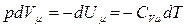 . (3.3.2)
. (3.3.2)
Теплоемкость системы в адиабатном процессе равна нулю. Это относится к термодинамической системе любой природы.
Получаем уравнение адиабаты через P и V
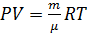 продифференцируем
продифференцируем
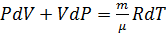 или
или 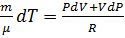
Только что получили
 тогда
тогда 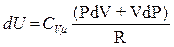
При адиабатическом процессе 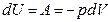 тогда
тогда
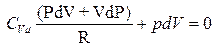 умножим на Rи раскроем скобки
умножим на Rи раскроем скобки
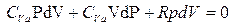
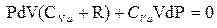 разделим на
разделим на 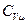
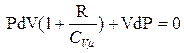 (22)
(22)
Обозначим за  и воспользуемся уравнением Майера
и воспользуемся уравнением Майера 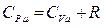 откуда
откуда 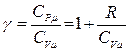
Тогда ур-е (22) перепишется
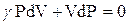 Разделим переменные умножив на
Разделим переменные умножив на 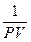
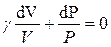 или
или
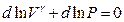 или
или
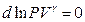
Проинтегрируем и получаем
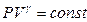 - Уравнение адиабаты или уравнение Пуассона, где
- Уравнение адиабаты или уравнение Пуассона, где 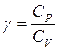 - показатель адиабаты или коэффициент Пуассона
- показатель адиабаты или коэффициент Пуассона
Уравнение адиабаты можно получить через другие параметры, например V,T
Согласно уравнению Менделеева - Клайперона
P~T/V
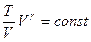
Тогда приходим к уравнению адиабаты в координатах (V,T), связывающему температуру и объем идеального газа в адиабатном процессе:
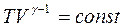 , (3.3.4)
, (3.3.4)
Аналогично
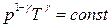 . (3.3.6)
. (3.3.6)
Найдем выражение для работы, совершаемой идеальным газом в адиабатном процессе при переходе из состояния 1 с параметрами 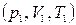 в состояние 2 c параметрами
в состояние 2 c параметрами 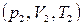 .
.
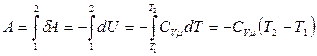 . (3.3.7)
. (3.3.7)
Поскольку численное значение работы и ее знак удобно определять по графику процесса, изображенного в координатах 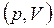 , адиабату часто изображают именно в этих координатах. На рис. 3.3.1 изображены изотерма и адиабата для равных масс идеального газа.
, адиабату часто изображают именно в этих координатах. На рис. 3.3.1 изображены изотерма и адиабата для равных масс идеального газа.
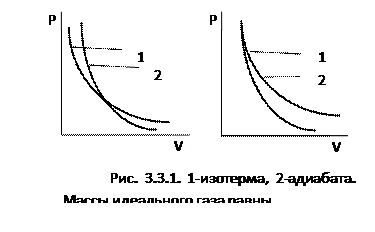 Большая крутизна адиабаты по сравнению с изотермой может быть объяснено из термодинамических представлений. Пусть изотермическое и адиабатное расширение начинаются из одного и того же состояния. В изотермическом процессе давление уменьшается за счет уменьшения объема, а в адиабатном процессе – за счет уменьшения объема и уменьшения средней кинетической энергии молекул, то есть быстрее, чем в изотермическом процессе. Рассуждая аналогично в случае начала изотермического и адиабатного сжатия из одного и того же состояния, приходим к выводу, что увеличение давления в адиабатном процессе идет медленнее.
Большая крутизна адиабаты по сравнению с изотермой может быть объяснено из термодинамических представлений. Пусть изотермическое и адиабатное расширение начинаются из одного и того же состояния. В изотермическом процессе давление уменьшается за счет уменьшения объема, а в адиабатном процессе – за счет уменьшения объема и уменьшения средней кинетической энергии молекул, то есть быстрее, чем в изотермическом процессе. Рассуждая аналогично в случае начала изотермического и адиабатного сжатия из одного и того же состояния, приходим к выводу, что увеличение давления в адиабатном процессе идет медленнее.
Можно показать, что теплоемкость в изотермическом процессе равна бесконечности
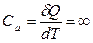 при T = const, (3.3.8)
при T = const, (3.3.8)
при постоянном давлении и при постоянном объеме теплоемкости имеют некоторые конечные значения
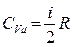 ,
, 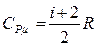 , (3.3.9)
, (3.3.9)
в адиабатном процессе теплоемкость равна нулю, т.к. 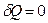 .
.
Рассмотрим теперь процессы с промежуточными значениями теплоемкости, которая в течение процесса не изменяется 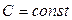 . Процессы, идущие при постоянной теплоемкости, называются политропическими процессами. Пусть адиабатный процесс, совершаемый над одним молем идеального газа является квазиравновесным.
. Процессы, идущие при постоянной теплоемкости, называются политропическими процессами. Пусть адиабатный процесс, совершаемый над одним молем идеального газа является квазиравновесным.
Согласно первому началу термодинамики для рассматриваемого случая получаем
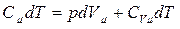 , (3.3.10)
, (3.3.10)
где 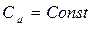 при политропических процессах. С учетом
при политропических процессах. С учетом 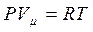
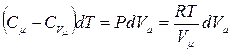 , откуда
, откуда 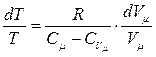 .
.
Из уравнения Майера 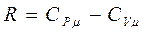 , следовательно
, следовательно
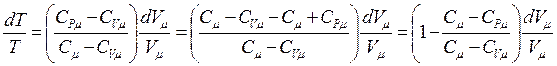
Величина 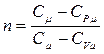 называется показателем политропы. Тогда
называется показателем политропы. Тогда
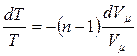 . (3.3.11)
. (3.3.11)
Интегрируя правую и левую части (метод разделения переменных), получим
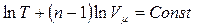 или
или
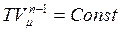 (3.3.12)
(3.3.12)
- уравнение политропы. С помощью уравнения Менделеева-Клапейрона его можно записать в виде:
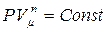 . (3.3.13)
. (3.3.13)
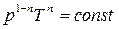 . (3.3.14)
. (3.3.14)
Очевидно, что
при С = 0; n = γ; 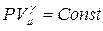 — уравнение адиабаты;
— уравнение адиабаты;
при С = ∞; n = 1; 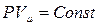 — уравнение изотермы;
— уравнение изотермы;
при С = Ср; n = 0; P = Const — уравнение изобары;
при C = Cv; n = 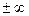 ;
; 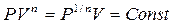 , но
, но 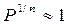 , следовательно, V = Const — уравнение изохоры.
, следовательно, V = Const — уравнение изохоры.
Все изопроцессы являются частными случаями политропического процесса.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!