
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение состава экстрагируемых соединений
|
|
|
|
В практике экстракционных процессов используют различные методы установления состава извлекаемых соединений. Одним из распространенных методов является химический анализ экстрагируемого соединения на все компоненты. Для этого в оптимальных условиях экстракции добиваются насыщения экстрагента по металлу и в аликвотных частях экстракта определяют известными методами все предполагаемые компоненты экстрагируемого комплекса. В первую очередь устанавливают отношение между реагентом и металлом, определяя их концентрацию по отдельности, затем анионную часть (Cl-, Br-, J-, SCN-, NO3-, ClO4-, CCl3COO- и т.д.) экстрагируемого комплекса. Для металлогенидных комплексов устанавливают и концентрацию ионов водорода, которые необходимы для перевода реагента в катионную форму (R -реагент).
Ro + HClв «(RH)Clo
ТОАо +HNO3 в «(ТОА×Н)NO3 в
2(RH)Clo + CdCl42- «(RH)2[CdCl4]o + 2Cl-в
Нередко в составе комплекса определяют и нейтральные молекулы Н2О, HNO3, а если комплекс смешанный, то и ОН--группы.
После определения всех компонентов находят кратные отношения между ними:
для катионообменной экстракции – R:Me;
анионообменной экстракции - R:H+:Me:Х- (X - анион минеральной кислоты);
координационной экстракции – R:Me:X-.
Рассмотренный метод удобен, если нет избытка реагента и при экстракции не наблюдается сольватация. Для получения корректных данных, как правило, проводят холостой опыт, т.е. экстракцию осуществляют в оптимальных условиях только в отсутствии извлекаемого металла.
Для установления состава извлекаемого соединения широко применяется метод насыщения (это наиболее общий прием для исследования прочных экстрагируемых комплексов). Сущность метода заключается в установлении зависимости величины процента экстракции металла от концентрации реагента. Согласно методу строится графическая зависимость RMe, % от cR/cMe. Для этого необходимо иметь раствор экстрагента определенной концентрации в разбавителе. Затем путём многократного контакта с водным раствором, содержащим металл, насыщают органическую фазу т.е. связывают весь экстрагент, превращая его в экстрагируемый комплекс. Органическую фазу анализируют на содержание металла и устанавливают соотношение экстрагент:металл. Точка излома на кривой отвечает отношению концентраций реагирующих веществ в точке Хтэ на абсциссе координат. Если точка излома на кривой насыщения наблюдается нечетко, ее определяют экстраполяцией прямолинейных участков кривой до их взаимного пересечения. Этот метод очень удобен для простейших реакций экстракции
Mn+в + nRo «[MRn]o.
На практике поступают следующим образом. Концентрацию металла сохраняют постоянной, а концентрацию реагента изменяют, стараясь выдерживать кратное отношение R:Me > 0,5:1; 1:1; 2:1; 3:1.
Недостатком этого метода является то, что вблизи к насыщению могут образовываться комплексы иного состава, чем при избытке реагента. Метод малопригоден, если экстрагируются несколько комплексов различного состава.
Если извлекается комплекс малопрочный и, тем более, для его извлечения требуется избыток реагента, то используют логарифмический метод.
Метод прямой линии (Метод Асмуса). Метод используется для определения состава малопрочного экстрагируемого комплекса. Для определения стехиометрического отношения реагирующих компонентов применяют графический приём. Если по оси ординат откладывать величину 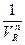 , где VR – объём реагента R в разбавителе, а n - стехиометрическое отношение компонентов в составе комплекса, а по оси абсцисс - соответствующие значения 1/D (D - коэффициент распределения) и задать различные значения величины n, то в общем случае получают набор кривых в координатах
, где VR – объём реагента R в разбавителе, а n - стехиометрическое отношение компонентов в составе комплекса, а по оси абсцисс - соответствующие значения 1/D (D - коэффициент распределения) и задать различные значения величины n, то в общем случае получают набор кривых в координатах 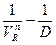 .
.
Эта зависимость только для истинного значения n будет выражаться прямой линией.
Практически к постоянному объему раствора металла с концентрацией cMe прибавляют различные объемы раствора экстрагента в органическом растворителе с концентрацией сR и доводят общий объем приготовленного раствора до постоянного значения V. После экстракции в органической фазе определяют содержание металла и строят графические зависимости 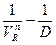 для различных задаваемых величин n (где n - целое число). Прямая линия указанной зависимости дает искомый коэффициент n
для различных задаваемых величин n (где n - целое число). Прямая линия указанной зависимости дает искомый коэффициент n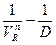 .
.
Преимущества метода:
1. Возможность правильного определения состава комплекса в условиях, когда концентрации исходных растворов реагирующих компонентов определены неточно или вообще неизвестны.
2. Возможность работы с загрязненными препаратами (при условии, что примесь не образует комплексов с компонентами основной реакции экстракции).
Для установления состава извлекаемого комплекса довольно широко используется метод изомолярных серий. Метод предложен Остромысленским, а позднее Жоб уточнил его выводы. Поэтому метод и называется в честь авторов «Остромысленского-Жоба».
Метод основан на определении отношения изомолярных концентраций реагирущих веществ, отвечающего максимальному выходу экстрагируемого комплекса. Кривая зависимости от состава раствора имеет экстремальную точку, которая отвечает максимально возможной концентрации комплекса MemRn, образующегося по реакции:
mMe + nR «MemRn
Положение кривой однозначно связано со стехиометрическими коэффициентами m и n. Для выполнения анализа готовят растворы обоих компонентов одинаковой молярной концентрации и смешивают их в антибатных отношениях (от 1 до 9; от 9 до 1 мл), сохраняя общий объем раствора (VMe + VR = const) неизменным. При этом суммарная концентрация грамм-молей обоих компонентов в общем объёме смеси åcMecR остается постоянной. Экстракцию проводят в оптимальных условиях извлечения, при постоянной ионной силе и рН раствора. Если используют буферный раствор, то его подбирают так, чтобы между компонентами изомолярной серии и буферной смеси не было комплексообразования. Определив степень извлечений в каждом случае, рассчитывают содержание металла в органической фазе и строят график (рис. 5) cMe = f(VR/VMe) и определяют положение максимума экстракции на изомолярной кривой. Максимум экстракции соответствует стехиометрическому соотношению реагирующих компонентов. Если максимум экстракции нечёткий, то его положение определяют экстраполяцией, для этого проводят касательные к кривым изомолярной серии до их пересечении. Точка пересечения показывает отношение реагирующих компонентов. Метод используется при условиях, когда
1) химическая реакция между реагирующими веществами протекает строго по рассматриваемому уравнению и нет процессов гидролиза, ассоциации и т.п.;
2) в системе образуется только одно комплексное соединение;
3) ионная сила растворов изомолярной серии сохраняется постоянной.
Метод малопригоден для исследования высококоординационных соединений типа MеRn, где n > 3-4.
В некоторых случаях бывает полезным применение метода обменных межфазных реакций. Суть его заключается в том, что приводят в контакт opганическую фазу, содержащую изучаемый комплекс, с водной фазой, содержащей соединение другого металла известного состава. Стехиометрия обмена даёт возможность установить форму существования комплекса в органической фазе. Например, таким образом было установлено, что соединение палладия в системе с солями ЧАО в органической фазе представляет собой двухъядерный комплекс.
{(R4N)2[Pd2Cl6]}o + (PtCl62-)в + 2Cl-в «{(R4N)2[PtCl6]}o + 2(PdCl42-)в
Соотношение Pd:Pt в обменной реакции составляет 2:1, если бы был в форме моноядерного комплекса, соотношение было бы 1:1.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1947; Нарушение авторских прав?; Мы поможем в написании вашей работы!