
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 11. Синтетические иониты. Основные типы, химизм процессов, выбор систем. Неорганические ионообменники. Комплексообразующие сорбенты
|
|
|
|
Различают неорганические и органические ионообменники. Природные минеральные ионообменники представляют собой, как правило, кристаллические алюмосиликаты.
Наиболее важными представителями этой группы являются цеолиты. К ним относятся такие минералы, как шабазит (CaNa2)(Si2Al06)2•6H20, стильбит (Na,Ca)Al2Si6016•6H20, натролит Na2[А12Si3010 ]2Н2О. Цеолиты обычно имеют трехмерную «каркасную» решетку, состоящую из «ажурной» структуры тетраэдров и содержащую до 50% от общего объема кристалла пустот и каналов. Входные отверстия (окна) из каналов в полости цеолитов образованы кольцами из атомов кислорода и являются наиболее узкими местами каналов.
Из-за их ограниченных размеров на цеолитах способны к обмену лишь относительно небольшие ионы, например, щелочных, щелочноземельных металлов, ионы никеля, кобальта, цинка. Обменная емкость, определяемая соотношением Si/Al в структуре ионита, наиболее высока для цеолитов А и Х (5,5 и 4,7 мг-экв/г гидратированного цеолита). Обменная емкость у самого распространенного в природе цеолита - клиноптилолита составляет 2,2 мг- экв/г. Часто на цеолитах наблюдается неполный обмен ионов, т.к. существуют центры, доступные одним и недоступные другим ионам. В этих случаях степень обмена ионами сильно зависит от температуры.
Цеолиты - типичные микропористые сорбенты, охотнее всего сорбирующие полярные вещества. Поэтому они применяются как прекрасные осушители газов и жидкостей: молекулы воды сорбируются в их полостях, ориентируясь вокруг обменных катионов. В отсутствие значительных количеств полярных веществ цеолиты хорошо сорбируют и неполярные вещества, если они могут входить в кислородные кольца цеолита.
Цеолиты успешно используют в составе моющих средств (например, цеолит 4А), в атомной промышленности в качестве поглотителя
радиоактивного Cs (клиноптилолит), в процессах разделения ионов и т.д.
У глинистых минералов чаще всего встречается слоистая решетка, состоящая из слоев кремнекислородных тетраэдров и алюмокислородных октаэдров, наложенных друг на друга и образующих элементарный пакет.
Кристаллы глинистого минерала состоят из десятков и сотен таких элементарных пакетов, собранных в стопки и удерживаемых вместе Ван-дер- ваальсовыми силами межмолекулярного притяжения и отчасти водородными связями. Различают минералы типа 1:1 (при наличии в элементарном пакете 1 октаэдрического и 1 тетраэдрических слоев) и 2:1 (содержит 2 тетраэдрических слоя). Элементарные пакеты минералов типа 2:1 заряжены отрицательно. Их заряд возникает в результате частичного изоморфного замещения в тетраэдрическом слое четырехзарядных катионов кремния на трехзарядные катионы алюминия и в октаэдрическом слое - трехзарядного катиона алюминия на двухзарядный ион магния. В решетках минералов типа 1:1 изоморфного замещения практически нет, поэтому их отрицательный заряд невелик и обусловлен диссоциацией функциональных групп = SiOH и = AlOH, образующихся на краях, углах и в местах излома пакетов.
Кристаллы минералов весьма малы и являются коллоидными частицами. Например, кристаллы монтмориллонита можно наблюдать лишь в электронный микроскоп. Из-за высокой дисперсности минералы имеют большую поверхность и являются хорошими сорбентами (особенно для полярных веществ) и наполнителями. Обменная емкость различна и колеблется от 10 (например, у каолинита) до 100 - 140 мг-экв/100г (монтмориллонит, вермикулит). Все глинистые минералы проявляют высокую избирательность к иону цезия. Для вермикулитоподобных минералов характерна высокая селективность к ионам K+, NH4+, Rb+, Cs+.
Синтетические неорганические ионообменники получают на основе алюмосиликатов. Этот тип ионообменников называют пермутитами, их состав отвечает общей формуле Al203-nSi02-mNa20-pH20.
При определении следов элементов часто используют ионообменную целлюлозу и синтетические неорганические ионообменники на основе чистых соединений (вольфрамат, молибдат циркония, оксиды Zr (IV), Th (IV), Ti (IV) и Sn (IV)).
Синтезирован класс неорганических ионообменников на основе фосфатов циркония и титана, имеющих следующую структуру:
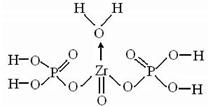
|
В зависимости от условий получения цирконилфосфатный ионообменник может иметь полимерную аморфную структуру или кубическую кристаллическую решетку. Данные ионообменники обладают высокой избирательностью по отношению к ряду ионов, таких как уранил-ионы U022+, позволяют отделить его от продуктов деления урана (Cs, Sr, Ce, Pu и т. д.).
После освоения производства синтетических ионообменных органических смол сфера применения неорганических ионообменников существенно сократилась. Ионообменные смолы являются высокополимерными соединениями, содержат фиксированные ионогенные группы (функциональные группы) и эквивалентное им по заряду количество ионов противоположного знака - противоионы. Противоионы являются легко подвижными и свободно переходят из ионита во внешнюю среду в обмен на эквивалентное количество других ионов того же знака. Иониты не растворимы в воде и органических растворителях, устойчивы по отношению к кислотам и щелочам, к действию окислителей, механически прочны, окрашены в различные цвета.
В зависимости от того, какие ионы способны обменивать иониты с внешней средой, их можно разделить на следующие группы:
Таблица - Техническая характеристика ионообменных смол
| Марка | Активные группы | Размер частиц, мм | Обменная ёмкость, ммоль/г сухого обменника | |||||||
| по 0,1 н. HC1 | по 0,1 н. NaCl | |||||||||
| Анионит AB-17-8 | [К+(СНз)з]С1- | 0,3 - 1,2 | 3,4 - 4,3 | 2,8 | ||||||
| Анионит ЭДЭ-10П | R1 -N+ R2 R3 =N; =NH; | 0,4 - 1,8 | 8,0 - 9,5 | 1,0 | ||||||
| Анионит AB-16 ГС | N+; =N; =NH; | 0,4 - 1,6 | 8,0 - 10,5 | 1,2 - 2,0 | ||||||
| Анионит АН-2Ф | =N; =NH; -OH | 0,4 - 2,0 | 7,5 | - | ||||||
| Анионит АН-1 | =NH; -NH2 | 0,4 - 2,0 | 4,5 - 5,5 | - | ||||||
| Анионит АН-31 | =N; =NH; OH- | 0,4 - 2,0 | 9,5 | - | ||||||
| Катионит КУ-1 | -SO3H; OH- | 0,4 - 2,0 | 4,2 | 2,0 | ||||||
| Катионит КУ-2-8 | -SO3H | 0,3 - 1,2 | - | 4,9 - 5,1 | ||||||
| Катионит КБ-4 | -COOH | 0,3 - 1,5 | - | 8,5 - 10,0 | ||||||
| Катионит КБ-4П-2 | -COOH | 0,2 - 1,0 | - | 9,5 - 10,5 | ||||||
| Катионит Duolit ES-463 | Сб^-РО^Ь | 0,3 - | 1,2 | 6,6 | - | |||||
| Амфолит Retardion 11 A 8 | -N+(CH3)3; -COOH | 0,1 - | 0,3 | 1,2 | - | |||||
1) Катионообменные смолы (катиониты) содержат кислотные группы: сульфогруппу - SO3H, карбоксильную - COOH и др. Подвижный ион водорода кислотных групп способен обмениваться на другие катионы, находящиеся в растворе, например, по реакции:
2R - SO3-H + + Mg2+ о (R - SO3)2Mg + 2H+
где R - полимерная матрица смолы.
2) Анионообменные смолы (аниониты) содержат в своей структуре реакционноспособные основные группы. Наиболее распространены аниониты с группой четвертичного аммониевого основания с хлоридом или гидроксидом в качестве противоиона: R-CH2N(CH3)3+Cl-, R-CH2N(CH3)3+OH- (хлоридная и гидроксильная форма анионита). Функциональная группа -CH2N(CH3)3+ - относительно сильное основание. Слабоосновные анионитные смолы часто содержат вторичные или третичные аминогруппы.
3) Амфолиты - иониты, содержащие закрепленные кислотные и основные группы и в определенных условиях выступающие либо как катиониты, либо как аниониты [27]. Биполярные смолы почти не поглощают неэлектролиты и слабо удерживают электролиты. Это свойство используется для группового разделения веществ. В отличие от механических смесей катионита и анионита биполярные смолы практически полностью освободить от адсорбированных ионов простой промывкой колонки.
Синтезированы бифункциональные смолы, содержащие сульфо (-SO^) и карбоксильные (-СООН) группы и фенольные группы (-C6H4OH). Такие ионообменники используют как в сильнокислотных растворах, так и в щелочных.
В настоящее время получены ионообменные смолы, содержащие в своем составе сложные функциональные группы (хелатные иониты), характеризующиеся высокой селективностью по отношению к ионам определенных металлов.
Разнообразно применение ионообменных смол: хроматографическое разделение (в том числе групповое разделение веществ заряженных и незаряженных и разделение по знаку заряда), удаление ионов из растворов, концентрирование ионов, изменение солевого состава жидкостей, введение нужных ионов в реакционную смесь при проведении реакции посредством фильтрования через колонку, катализ.
По сравнению с другими ионитами ионообменные смолы отличают высокая обменная емкость, хорошие кинетические характеристики в сочетании с хорошими фильтрационными свойствами, высокая химическая устойчивость в агрессивных условиях, удовлетворительная механическая прочность, универсальность действия. По отдельным показателям смолы уступают некоторым другим ионообменным материалам: циркониевым ионитам - по радиационной и термической стойкости, а также по селективности в отношении щелочных и щелочноземельных металлов; ионообменным целлюлозам - по проницаемости для макромолекул и мягкости условий сорбции и десорбции; поверхностно-слойным ионообменникам - по пригодности для ВЭЖХ.
Получают ионообменные смолы методами сополимеризации в виде правильных шариков (бисер) или реже методами поликонденсации в виде зерен произвольной формы. Среди катионообменников полимеризационного типа широкое применение нашли сополимеры стирола и дивинилбензола, которые синтезируют в присутствии серной кислоты при определенной температуре, получаемый продукт имеет трехмерную пространственную структуру:
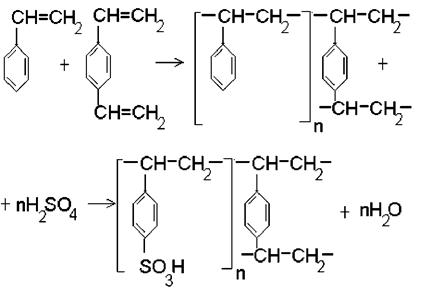
|
Каждая молекула дивинилбензола, как мостик, соединяет две соседних линейных цепи. Трехмерная цепная структура такого рода значительно достраивается и разветвляется в пространстве.
Промышленностью выпускаются смолы на базе производных нафталина, резорцина, бутадиенового каучука, производных стирола и бутадиена, стирола, дивинилбензола и малеинового ангидрида, фенола и формальдегида, поливинилового спирта, полиэтилена, поливинилхлорида, метакриловой кислоты и акриламида, метакриловой кислоты и резорцина и т.д. Свойства матрицы существенно сказываются на свойствах ионита, в том числе и на его избирательности к различным ионам, что особо заметно у слабокислотных и слабоосновных ионитов.
Ионогенные группы вводят в полимер сразу при синтезе, либо на последней стадии синтеза путем специальных реакций сульфирования, аминирования, фосфорилирования и т.д.
Обычные смолы имеют сетчатую гелевую структуру без истинных пор. Распределение поперечно-сшивающих мостиков редко бывает равномерным. Часто в зерне наблюдаются участки повышенной и пониженной сшитости. Такие сгустки и разрежения рассеяны по зерну случайным образом. Специальными методами получают так называемые изопористые смолы (ИП) с равномерным распределением мостиков в полимерной сетке геля. Помимо смол с непрерывно-гелевой структурой вырабатываются макропористые (МП), или макроретикулярные, смолы, в структуре которых содержатся истинные поры надмолекулярного размера (чаще 20 - 100 нм, иногда до 104 нм). Макропористые смолы характеризуются повышенной скоростью сорбции ионов.
 Пространственная структура карбоксильного катионита, полученная полуэмпирическим методом MINDO 3
Пространственная структура карбоксильного катионита, полученная полуэмпирическим методом MINDO 3
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2809; Нарушение авторских прав?; Мы поможем в написании вашей работы!