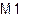КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тверді розчини і ізоморфізм
|
|
|
|
Більшість мінеральних фаз, що зустрічаються у геохімічних системах, властивий непостійний склад, що залежить від P-T-X параметрів конкретної системи і надзвичайно чутливий до їх змін. Мінерали без домішок є рідкістю. Ми привикли, що хімічний склад мінералу відображається його формулою. Насправді хімічна формула – це тільки ідеалізовані стехіометричні співвідношення найбільш поширених, незамінних для цього мінералу хімічних елементів. Більшість мінералів характеризується значними варіаціями хімічного складу, відхиленням від ідеальної формули.
Можна назвати небагато мінералів, хімічний склад яких залишається незмінним незалежно від умов і в яких формульні хімічні елементи складають більше 99 ваг. %. Такими є діамант, кварц, ґетит, каолініт, силіманіт. Інші мінерали завжди мають мінливий склад (наприклад, сфалерит (Zn,Fe,Mn,Cd,In)S, сидерит (Fe,Mg,Mn,Ca)[CO3]) або ж змінюють свій склад залежно від температури: при низьких температурах формуються мінерали із складом, що наближається до формульного, а при високих температурах ростуть кристали із великою кількістю домішок (ортоклаз, кальцит, пірит, галеніт).
Базовим поняттям кристалічної структури є кристалохімічна позиція – специфічна позиція в кристалічній структурі мінералів, що характеризується координаційним числом оточення, симетрією оточення, типом хімічного зв’язку, міжатомними віддалями між центральним атомом і оточенням, енергетичними характеристиками центрального атома (електронегативність, валентність).
Кристалохімічна позиція повторються у просторі згідно законів симетрії і заселюється одним сортом атома або декількома різними сортами атомів із близькими хімічними властивостями. Кількість кристалохімічних позицій змінюється від одної (наприклад, діамант C) до 25 (наприклад у везувіану) і більше.
Просторове поєднання кристалохімічних позицій створює структурний мотив мінералу. Збільшення кількості кристалохімічних позицій спричинює неоднорідність структури, ускладнює структурний мотив, тобто веде до зменшення ентропії мінералу, але може давати виграш в ентальпії. Поряд із цим, заселення однієї кристалохімічної позиції атомами різних хімічних елементів, що розподілені в об’ємі кристалу випадковим, хаотичним чином, призводить до зростання ентропії. Якщо результуючим наслідком таких рекомбінацій атомів є пониження вільної енергії твердої кристалічної речовини, мінерал такого складу отримує право на існування, стає стабільним за P-T-X умов свого виникнення.
| 
| ||||
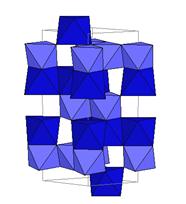
| Рис. 5.3. Структура ільменіту. У структурі дві кристалохімічні позиції - М1 і M2. Обидві вони мають координацію 6 – центральні атоми оточені шістьма атомами кисню. Відрізняються міжатомними віддалями і, перш за все, валентністю, тобто типом гібридизації ковалентних зв’язків. |
| Іони, що входять у позицію | Електронегативність | Іонний радіус, A |
| M1 | ||
| Fe2+ Mg2+, Mn2+, Fe3+, Al3+, Cr3 | 1.8 | 0,61 |
| M2 | ||
| Ti4+ V4+, Fe3+, Al3+ | 1.8 | 0,605 |
Як приклад – розглянемо структуру ільменіту (рис. 5.3). Дві кристалохімічні позиції структури корундового типу відрізняються тільки міжатомними віддалями – позиція V1 має дещо більший об’єм, порівняно із позицією M2. Це призводить до перерозподілу елементів між ними із входженням чотирьохвалентних металів із малим іонним радіусом у позицію M2, а двохвалентних із більшим радіусом у позицію M1. Зверніть увагу на те, що у склад ільменіту можуть входити іони, що мають здатність формувати із оксигеном структури корундоваго типу – Al (корунд Al2O3) і Fe3+ (гематит Fe2O3).
Варіації хімічного складу мінералів є результатом реалізації можливості заселення однієї і тієї ж кристалохімічної позиції різними іонами.
Результат цього ми можемо назвати по різному. Якщо ми розглядаємо мінерал простого складу, для прикладу кальцит, то в його складі будуть мінятися співвідношення металів (Cа, Mg, Fe, Mn, Zn), тоді як атомні співвідношення метал/карбон та метал/оксиген залищуться постійними, рівними 1 і 3, відповідно. Створюється враження, що один метал витісняє, заміщує інший у мінералі.Таке розуміння явища проявляється у виразі «заміщення одного атома (іону) на іншим». У 1819 р., Е.Мітчерліх спостерігаючи кристалізацію із розчину солей змінного складу K2H[PO4]….K2H[AsO4], встановив, якщо розчин містив як фосфати так і арсенати калію, то формувались кристали K2H[(As,P)O4]·12H2O із зміною складу від одного крайнього члену до іншого, по мірі зміни співвідношення As/P у складі розчину. При цьому морфологія кристалів залишалась постійною. Таке явище Е.Мітчерліх назвав ізоморфізмом, відмітивши незмінність форми кристалів при зміні їх складу, тобто заміщення As на P. Таким є походження і зміст поняття «ізоморфне зміщення».
Також варіації складу мінералу можна розглядати як наслідок змішування різних молекул із однаковою стехіометрією. Наприклад високотемпературкий ортоклаз завжди містить, поряд із K, значні концентрації Nа і тому його можна розглядати як суміш двох молекул KAlSi3O8 та NaAlSi3O8. Такий підхід виявляється у використанні виразу «змішаний кристал». Але варто пам’ятати, що змішування двох компонентів призводить або до формування механічної суміші їх частинок, або ж до взаємного розчинення. Визначальним свідченням розчинення є наявність теплового ефекту у досліджуваного процесу.
Вперше утворення надлишку тепла при кристалізації речовин проміжного Вперше явище такого типу було описано Я.Вант-Гоффом в 1890 р., який доказав зміну енергії при формуванні кристалів проміжного складу і назвав такі речовини твердим розчином
У такому випадку мінерал перетворюється на твердий (кристалічний) розчин двох або більше ізоструктурних речовин. Розчинником тут слугує компонент, що присутній в найбільшій кількості. Це можна продемонструвати на прикладі сфалериту із вмістом 10 ат.% Fe та 2 ат. % Mn. В такому випадку мінерал із загальною формулою (Zn,Fe,Mn)S можна подати як результат розчинення у власне сфалериті ZnS кубічних FeS та MnS в різних пропорціях. Деколи для таких мінералів змінного складу використовують термін «змішаний кристал».
Тому, традиційно, для опису явища формування кристалів із однаковою структурою, але змінним хімічним складом використовуються два рівнозначні поняття «утворення твердих розчинів» і «ізоморфізм».
Поняття «ізоморфні суміші» та «твердий розчин» у більшості випадків є синонімами, взаємно замінимі, причому поняття «тверді розчини» є більш ширшим і зараз домінуючим, особливо в англомовній літературі.
Тверді розчини утворюються в процесі кристалізації мінералу і коли йде мова про «ізоморфне заміщення» то мається на увазі заселення вакантної позиції у поверхневому шарі кристалу, що росте. За певних умов може відбуватися дифузія атомів одного сорту атомів із середовища в мінерал і зустрічна дифузія іншого сорту атомів із мінералу в середовище (причому обидва сорти займають у мінералі одну і ту ж кристалохімічну позицію).
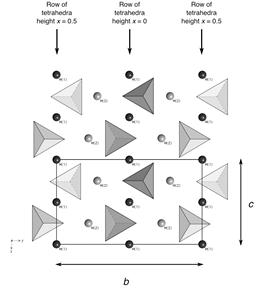
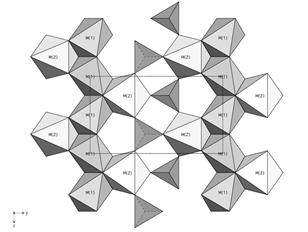
Взявши за основу рис. 5.4 розглянемо поняття твердого розчину на прикладі олівіну (Mg,Fe,Mn,Ni,Ca)2[SiO4].
Структура олівіну складається із трьох катіонних позицій, що відрізняються координаційним оточенням із атомів оксисену:
1. позиція M(1) утворює в структурі ланцюжки; її координаційний поліедр близький за формою до октаедра;
2. позиція M(2) ізольована, характеризується більшими віддалями катіон–оксиген, порівняно із M(1); координаційний поліедр – неправильний шестивершинник.
3. позиція T ізольована; координаційний поліедр – тетраедр.
|  Mg 0.86 Å
Fe2+ 0.92 Å
Mg 0.86 Å
Fe2+ 0.92 Å
|
| Рис. 5.4. Кристалічна будова олівіну. Зліва кружками показані дві кристалохімічних позиції катіонів у структурі (M(1) і M(2) і тетраедрична позиція Si. Позиції оксигену не показані. Справа – поліедрична модель одного атомного шару в структурі олівіну. |
У мінералу форстериту Mg2[SiO4] позиції M(1) і M(2) заселені магнієм, а позиція T – силіцієм. В природі існують мінерали із структурою, ідентичною форстериту – фаяліт Fe2[SiO4] і тефроїт Mn2[SiO4], в яких позиції M(1) і M(2) заселені ферумом і манганом, відповідно. Коли ж форстерит росте в магмі, яка характеризується високою активністю Fe і Mn, то ці метали, в силу близькості їх хімічних властивостей із Mg, будуть заселяти випадковим чином позиції M(1) і M(2) поряд із Mg, утворюючи кристали проміжного складу між Mg2[SiO4] – Fe2[SiO4] – Mn2[SiO4], тобто твердий розчин олівін із формулою (Mg,Fe,Mn)2[SiO4].
Формула мінералу (Mg0.85Fe0.15)2[SіO4] означає, що ми маємо твердий розчин, на 85% складений форстеритом (Fo) і на 15% фаялітом (Fa); іншим чином формулу такого мінералу можна записати як Fo0.85Fa0.15, де Fo і Fa – сполуки (мінали), що взаємно розчиняються. Мінали можуть відповідати реально існуючим мінералам, або ж бути уявними, так як відповідні сполуки в чистому вигляді нестабільні в природніх умовах (хоча часто можуть бути синтезовані в лабораторії).
Якщо два мінерали можуть утворювати тверді розчини між собою і, як результат їх взаємного розчинення, спостерігається неперервна зміна хімічного складу твердого розчину від одного мінералу до іншого, тоді ми маємо справу із неперервним рядом твердих розчинів. В термінах ізоморфізму йому відповідають поняття повного або досконалого ізоморфізму. Такий стиль взаємного розчинення спостерігається між крайніми членами ряду олівінів – від форстериту Mg2[SіO4] до фаяліту Fe2[SіO4].
Якщо ж в ході змішування двох крайніх фаз стабільні кристалічні структури виникають тільки в декількох вузьких інтервалах, тоді ми маємо справу із перервними рядами твердих розчинів. В термінах ізоморфізму йому відповідають поняття часткового або недосконалого ізоморфізму. Такими є ряди твердих розчинів альбіт Na[AlSi3O8] – ортоклаз K[AlSi3O8] та кальцит Ca[CO3] – магнезит Mg[CO3].
У випадку формування стабільної структури в певному інтервалі хімічного складу існує гомогенна кристалічна фаза – мінерал; збільшення вмісту одного із компонентів призведе до нестабільності твердого розчину і перетворення гомогенної мінеральної фази в зросток двох мінералів. Це явище фазової гетерогенізації називається розпадом твердого розчину. Продуктами розпаду твердих розчинів є включення мінералу–колишнього розчиненого компоненту, закономірним чином розміщені в матриці мінералу–колишнього розчинника. Орієнтація і морфологія дочірних мінеральних включень часто підпорядковується кристалічній структурі мінералу-господаря (рис.). Структури, що утворюються таким чином, називаються структурами розпаду твердих розчинів.
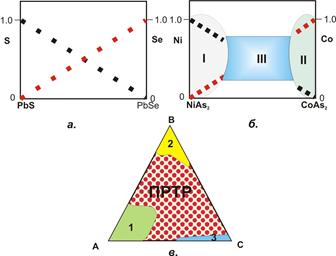
| Рис. 6.3. Схеми варіацій хімічного складу твердих розчинів. ПРТР – продукти розпаду твердих розчинів. а – зміна вмістів S і Se в неперервному ряді твердих розчинів галеніт-клаусталіт Pb(S,Se); б – зміна вмісту Ni і Co в перервному ряді твердих розчинів рамельсбергіт–сафлорит (Ni,Co)As2; виділяються дві області існування неперевних твердих розчинів (І і ІІ) і область розриву змішування (ІІІ), в якій існують дві рівноважних фази – рамельсбергіт і сафлорит, склад яких відповідає полям І і ІІ. в – в трійній системі (A,B,С) існують три поля твердих розчинів (1, 2, 3), розділені областю незмішуваності, в якій три мінеральних фази мінливого складу можуть утворювати структури розпаду твердих розчинів. |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 880; Нарушение авторских прав?; Мы поможем в написании вашей работы!