
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В органічних сполуках
|
|
|
|
СТАН АТОМА КАРБОНУ І ХАРАКТЕР ЗВ’ЯЗКІВ
Елемент карбон, порядковий номер якого дорівнює 6, розміщується у другому періоді, головній підгрупі IV групи періодичної системи Д.І.Менделєєва. З електронної конфігурації карбону (1s22s22p2) випливає, що на двох енергетичних рівнях атома С перебуває шість електронів, з яких чотири знаходяться на зовнішньому, другому рівні:
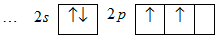
Зовнішні електрони атома зумовлюють спінвалентність, або ковалентність карбону.
Ковалетність – це кількість ковалентних зв’язків, що утворює атом; вона визначається кількістю неспарених електронів у атомі в основному стані або кількістю неспарених електронів, що з’являються в атомі при його збудженні.
Оскільки атом карбону в основному стані має два неспарених електрони, його ковалентність дорівнює двом, тобто він може утворювати два зв’язки. Однак практично в усіх органічних сполуках атом Карбону утворює чотири зв’язки, що стає можливим завдяки збудженню внаслідок поглинання певної кількості енергії (405,6кДж/моль). У збудженому стані, який позначають за допомогою зірочки С*, атом карбону має вже чотири неспарених електрони:
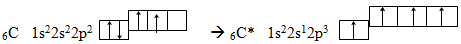
Зрозуміло, що збудження атома С при переході із стану 2s22p2 у стан 2s12p3 потребує затрати енергії, яка не тільки компенсується, а й дає енергетичний виграш при утворенні хімічних зв’яків. Наприклад, енергія, що виділяється при утворенні кожного зв’язку С – Н у вуглеводнях, становить 415,5кДж/моль. Отже при утворенні двох додаткових (порівняно з основним станом) ковалентних зв’язків виділяється енергії на 415,5×2 – 405,7 = 425,3кДж/моль більше, ніж її потрібно для збудження атома.
Кожна орбіталь збудженого атома С* характеризується певною формою та енергією (рис. 7.5 і 7.6).
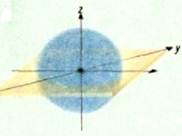 Рис. 7.5 – s-Орбіталь
Рис. 7.5 – s-Орбіталь
|
 Рис. 7.6 – Три р-орбіталі
Рис. 7.6 – Три р-орбіталі
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 795; Нарушение авторских прав?; Мы поможем в написании вашей работы!