
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зв’язок між двома атомами за допомогою однієї спільної електронної пари називається одинарним(простим), двох електронних пар – подвійним, трьох електронних пар – потрійним
|
|
|
|
 Так, у молекулі етану С2Н6 між атомами Карбону існує одинарний зв’язок (С–С), в етилені С2Н4 – подвійний (С=С), в ацетилені С2Н2 – потрійний (С≡С).
Так, у молекулі етану С2Н6 між атомами Карбону існує одинарний зв’язок (С–С), в етилені С2Н4 – подвійний (С=С), в ацетилені С2Н2 – потрійний (С≡С).
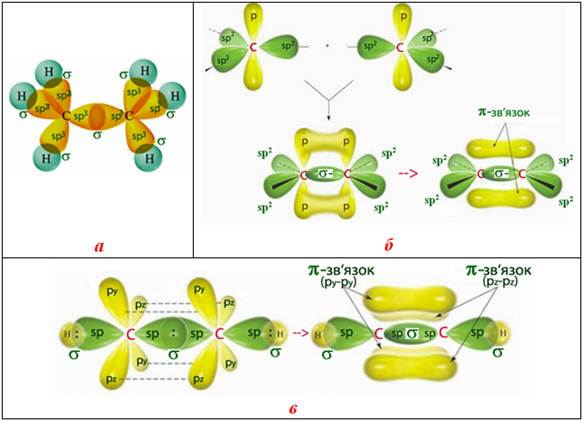
Рисунок 7.16 – Кратність зв’язку між атомами Карбону: а) одинарний s-зв’язок в етані Н3С–СН3; б) подвійний s+p-зв’язок в етилені Н2С=СН2; в) потрійний s+p+p-зв’язок в ацетилені НСºСН
Кратність зв’язку впливає на енергію: з підвищенням кратності зростає міцність зв’язку. Підвищення кратності приводить до зменшення між’ядерної відстані (довжини зв’язку) і збільшення енергії зв’язку.
3) Полярність – це характеристика ковалентного зв’язку, яка описує різну локалізацію електронної густини у між’ядерному просторі. Залежно від неї розрізняють полярний і неполярний ковалентні зв’язки.
Неполярним, або гомеополярним, називається такий зв’язок, при якому область перекривання електронних орбіталей розміщується симетрично відносно ядер сполучених атомів і однаковою мірою належить обом атомам.
Полярним, або гетерополярним, називається зв’язок, при якому область перекривання електронних орбіталей несиметрична і зміщена до одного з атомів.
Щоб визначити, в який бік буде зміщуватися електронна густина полярного ковалентного зв’язку, необхідно порівняти електронегативність обох атомів. За зростанням електронегативності найбільш поширені хімічні елементи розміщуються у такій послідовності:
Rb, K, Na, Li, Ca, Mg, Be, In, Al, Sr, Ga, Sb, Si, B,
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1120; Нарушение авторских прав?; Мы поможем в написании вашей работы!