
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природа хімічного зв’язку
|
|
|
|
| Однозначно встановлено, що будь-який хімічний зв’язок має електричну природу, тобто при його утворенні найбільш суттєву роль відіграють сили взаємодії між електричними зарядами, носіями яких є негативно заряджені електрони й позитивно заряджені ядра атомів. Суть взаємодії полягає у відштовхуванні однойменно заряджених частинок (ядро-ядро, електрон-електрон) і притяганні різнойменно заряджених (ядро-електрон). Зрозуміло, що система буде |  Рисунок 7.11 – Сили міжатомної взаємодії: відштовхування між електронними оболонками двох атомів та між їх ядрами; притягання між ядром одного атома і електронною оболонкою іншого і навпаки
Рисунок 7.11 – Сили міжатомної взаємодії: відштовхування між електронними оболонками двох атомів та між їх ядрами; притягання між ядром одного атома і електронною оболонкою іншого і навпаки
|
стійкою, якщо сили притягання переважають над силами відштовхування (рис. 7.11).
Зростання сил притягання при утворенні молекули порівняно з ізольованими атомами супроводжується виділенням енергії, внаслідок чого енергія системи зменшується. Отже, рушійною силою утворення хімічного зв’язку є прагнення ізольованих атомів до виграшу в енергії, який досягається при їх об’єднанні в систему; стійкість системи забезпечується виникненням області підвищеної густини негативного електричного заряду, що притягує до себе позитивно заряджені ядра атомів.
При утворенні хімічного зв’язку найважливішими є електрони зовнішнього шару, тобто валентні електрони, які утримуються ядром найменш міцно. Саме тому будова електронної конфігурації атомів є визначальним чинником при розгляданні умов утворення хімічного зв’язку.
Відповідно до запропонованого Льюїсом правила октету найбільш стабільними й енергетично вигідними є зовнішні оболонки з електронними конфігураціями благородних газів, тобто такі, що містять два (у випадку найближчого до ядра енергетичного рівня) або вісім електронів.
Будь-який хімічний зв’язок утворюється, якщо це енергетично вигідно – лише тоді, коли зближення ізольованих атомів приводить до зменшення повної енергії системи, яка складається з кінетичної і потенціальної енергій ядер атомів і електронів.
Для характеристики енергії системи, що містить два ізольованих атоми, які наближуються один до одного, застосовують так звані потенціальні криві (рис. 7.12).
| Верхня потенціальна крива 1 відображає збільшення загальної енергії системи у міру зменшення відстані r між двома атомами, оскільки при зближенні атомів з паралельними спінами (¯ і ¯) переважають сили відштовхування між їх електронними оболонками. При цьому зв’язок не утворюється. Нижня потенціальна крива 2 показує зменшення енергії системи у випадку зближення атомів, що мають антипаралельні спіни (¯ і ), на певну відстань – довжину зв’язку r0, на якій відбувається утворення хімічного зв’язку. Мінімум на потенціальній кривій 2 визначає е нергію зв’язку Е0. При подальшому зближенні атомів починають переважати сили відштовхування між їх ядрами, тому загальна енергія системи зростає. | 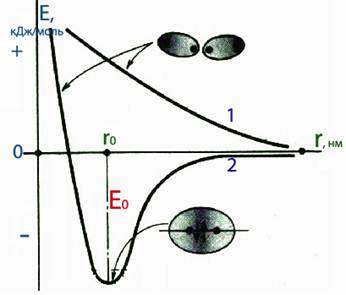 Рисунок 7.12 – Загальний вигляд потенціальних кривих для характеристики змінення енергії системи з двох атомів залежно від відстані між ядрами
Рисунок 7.12 – Загальний вигляд потенціальних кривих для характеристики змінення енергії системи з двох атомів залежно від відстані між ядрами
|
Енергія зв’язку – це міра міцності зв’язку, що визначається кількістю енергії, яка виділяється внаслідок утворення зв’язку.
Довжина зв’язку – це відстань між ядрами хімічно сполучених атомів.
Одиниці вимірювання енергії зв’язку: [кДж/моль] або – рідше – [еВ]. Енергія зв’язку характеризує його міцність: чим більше енергія зв’язку, тим він міцніший.
Довжину зв’язку вимірюють частіше у нанометрах [нм], пікометрах [пм], але інколи – в ангстремах [Å] (1нм=10–9м, 1пм=10–12м, 1Å=10–9м). Зі збільшенням радіусів атомів, між якими виникає зв’язок, зростає його довжина. Наприклад, довжини зв’язків у ряду гідрогенгалогенідів складають (нм): НF – 0,092; НCl – 0,128; HBr – 0,141; HI – 0,162.
| Довжина зв’язку завжди менше суми радіусів двох сполучених атомів, оскільки утворення молекули супроводжується, крім зміни енергії, й зміною густини електронних хмар. Наприклад, якщо при утворенні зв’язку між двома атомами Гідрогену, радіуси яких дорівнюють 0,053 нм, електронні хмари взаємно не проникали б одна в одну, то довжина зв’язку повинна була дорівнювати подвоєному радіусу: 0,053×2=0,106 нм. Насправді ж довжина зв’язку в молекулі Н2 становить 0,074 нм (рис. 7.13). Це свідчить про перекривання електронних хмар ізольованих атомів, що відбувається при утворенні |  Рисунок 7.13 – Довжина зв’язку в молекулі Н2
Рисунок 7.13 – Довжина зв’язку в молекулі Н2
|
зв’язку, тобто в молекулі змінюється густина і форма електронних хмар порівняно з ізольованими атомами.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 976; Нарушение авторских прав?; Мы поможем в написании вашей работы!