
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Параллельные реакции
|
|
|
|
Иногда исходные вещества реагируют одновременно в нескольких направлениях. Примеры параллельных реакций:
1. При нитровании фенола образуются одновременно п-, о-, м-нитрофенолы;
2. Разложение бертолетовой соли при нагревании:
 6KClO3 ® 2KCl + 3O2
6KClO3 ® 2KCl + 3O2
® 3KClO4 + KCl
Рассмотрим простейший случай двух параллельных необратимых мономолекулярных реакций: А ® В, А ® С.
Скорость 1-й реакции 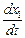 = k 1 (a – x),
= k 1 (a – x),
2-й реакции 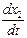 = k 2 (a – x);
= k 2 (a – x);
x 1 и x 2 – числа молей веществ В и С, образовавшихся к моменту времени t; x = x 1 + x 2 – общее число молей А, прореагировавших к моменту t.
Скорость превращения вещества А по двум направлениям равна сумме скоростей превращения по каждому из направлений:
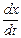 =
= 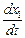 +
+ 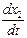 = k 1 (a – x) + k 2 (a – x) = (k 1 + k 2) (a – x).
= k 1 (a – x) + k 2 (a – x) = (k 1 + k 2) (a – x).
После интегрирования получим
k 1 + k 2 =  ln
ln 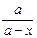 . (1)
. (1)
Это уравнение отличается от уравнения для необратимой реакции 1-го порядка тем, что в нем стоит сумма констант скоростей обеих параллельных реакций. В случае трех параллельных реакций 1-го порядка в левой части уравнения будет стоять сумма трех констант.
Для двух параллельных необратимых реакций 2-го порядка получим уравнение
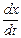 = (k 1 + k 2) (a – x) (b – x).
= (k 1 + k 2) (a – x) (b – x).
После интегрирования
k 1 + k 2 = 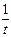 ×
× 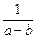 ln
ln 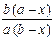 . (2)
. (2)
Уравнения (1) и (2) дают возможность определить сумму констант скоростей. Если же нужно найти каждую константу в отдельности, необходимо получить еще одно уравнение, связывающее эти константы. Например, для двух параллельных необратимых реакций 1-го порядка
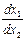 =
= 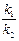 .
.
После интегрирования 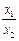 =
= 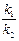 . (3)
. (3)
Определив в некоторый момент времени количества веществ В и С, равные x 1 и x 2, получим отношение k 1 / k 2, и, решив совместно уравнения (1) и (3), получим возможность рассчитать каждую константу в отдельности.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!