
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Числа переноса ионов
|
|
|
|
Зависимость подвижности ионов от температуры
Предельная подвижность ионов, а также удельная электропроводность электролитов всегда увеличиваются с повышением температуры (в противоположность электропроводности металлов, которая уменьшается с повышением температуры). Температурный коэффициент подвижности оказывается довольно большим; при нагревании раствора на 1oС подвижность, а следовательно, и электропроводность возрастают примерно на 2%. Наибольший температурный коэффициент характерен для ионов с относительно малой подвижностью и наоборот. Наличие положительного температурного коэффициента подвижности ионов объясняется уменьшением вязкости раствора с ростом температуры.
Так как l¥ = lо+ + lо– , то эквивалентная электропроводность при бесконечном разведении с температурой всегда возрастает.
При конечной концентрации связь l с подвижностью несколько сложнее. Для слабого электролита l = (l+ + l–)×a. Если с повышением температуры подвижности ионов возрастают, то степень диссоциации может и уменьшаться, поскольку диэлектрическая проницаемость раствора при нагревании уменьшается, то есть силы взаимодействия между ионами увеличиваются. Следовательно, кривая зависимости электропроводности от температуры может иметь максимум. Аналогичное явление наблюдается и в сильных электролитах.
Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Так как скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854).
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов:
t+ = 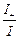 , t– =
, t– = 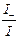 , t+ + t– =
, t+ + t– = 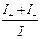 = 1;
= 1;
I+ = 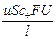 , I– =
, I– = 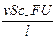 , I = I+ + I– =
, I = I+ + I– = 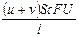 ;
;
t+ = 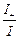 =
= 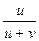 =
= 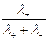 , t– =
, t– = 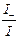 =
= 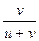 =
=  .
.
Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Так как подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая.
Выведенное соотношение позволяет вычислить числа переноса, если известны значения подвижностей ионов. С другой стороны, опытное определение чисел переноса дает возможность вычислить подвижности.
Видно, что число переноса не является характеристикой только данного иона, так как зависит от подвижности парного с ним иона. Таким образом, число переноса ti характеризует не индивидуальное свойство иона, а роль этого иона в миграционном переносе зарядов в данном растворе электролита. В бинарном растворе число переноса зависит от подвижности второго иона, а в многокомпонентном растворе еще и от соотношения концентраций компонентов раствора. Например, число переноса хлорид-иона в растворе НCl меньше, чем в растворе КCl той же концентрации, поскольку ионы водорода более подвижны, чем ионы калия.
Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа).
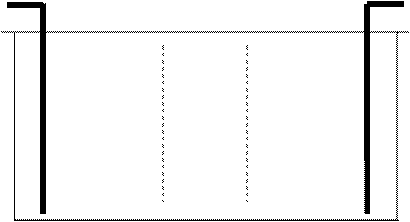   + Анод Катод – + Анод Катод –
А + + + + + + + + + + + + + + + + + + – – – – – – – – – – – – – – – – – – Б + + + + + + + + + + + + + + + + + + – – – – – – – – – – – – – – – – – – В – – – + + + + + + + + + + + + + + + – – – – – – – – – – – – – – – + + +
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3636; Нарушение авторских прав?; Мы поможем в написании вашей работы!
