
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация воды. рН растворов
|
|
|
|
Ионное равновесие в растворах электролитов: диссоциация воды, рН растворов, диссоциация слабых электролитов, гидролиз, буферные растворы, произведение растворимости
Диссоциация воды протекает по схеме
Н2О Û Н+ + ОН–
Константу диссоциации можно выразить как
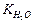 =
=  .
.
Так как степень диссоциации воды очень мала, то  можно считать постоянной и ввести ее в значение константы диссоциации
можно считать постоянной и ввести ее в значение константы диссоциации
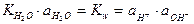 .
.
При Т = const Kw = const и не зависит от концентрации ионов Н+ и ОН–; Kw называется ионным произведением воды. При 25оС Kw = 1,008×10–14 . В нейтральном растворе  = 10–7 моль/л.
= 10–7 моль/л.
рН = - lg  - водородный показатель, введенный Зеренсеном (1909). рН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от температуры (увеличивается в 100 раз в интервале 20 – 100оС), то есть с ростом Т концентрация образующихся ионов Н+ и ОН– будет увеличиваться, и при t < 25оС рН = 7 будет соответствовать кислому раствору, а при t > 25оС - щелочному. Ниже приведены значения рKw = – lg Kw при различных температурах.
- водородный показатель, введенный Зеренсеном (1909). рН = 7 отвечает нейтральному раствору только при 25оС. Kw очень сильно зависит от температуры (увеличивается в 100 раз в интервале 20 – 100оС), то есть с ростом Т концентрация образующихся ионов Н+ и ОН– будет увеличиваться, и при t < 25оС рН = 7 будет соответствовать кислому раствору, а при t > 25оС - щелочному. Ниже приведены значения рKw = – lg Kw при различных температурах.
Таблица 4
Зависимость ионного произведения воды от температуры
| t, оС | ||||||||
| рKw | 14,944 | 14,535 | 14,167 | 13,997 | 13,833 | 13,535 | 13,262 | 13,017 |
Кислые растворы – такие, в которых [Н+] > [ОН–]; щелочные - такие, где [ОН–] > [Н+]. Так как мерой кислотности служит [Н+], то в ряду кислот более сильной будет та, у которой при одинаковой аналитической концентрации [Н+] выше (то есть больше степень диссоциации).
Из температурной зависимости рKw, воспользовавшись уравнением изохоры реакции, можно вычислить тепловой эффект диссоциации воды. При 20оС он равен 57,3 кДж/моль, что практически совпадает по абсолютной величине с экспериментально найденной теплотой нейтрализации сильной кислоты сильным основанием в водных растворах, поскольку протекающая при этом реакция обратна процессу диссоциации воды.
Следует помнить, что величины концентраций ионов Н+ в выражении для рН можно использовать взамен активностей только в случае достаточно разбавленных растворов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 387; Нарушение авторских прав?; Мы поможем в написании вашей работы!