
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация слабых электролитов
|
|
|
|
При диссоциации слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами. Рассмотрим простейший пример, когда молекула распадается только на два иона:
СН3СООН + Н2О Û СН3СОО– + Н3О+
На основании закона действующих масс напишем выражение для константы равновесия Ка:
Ка = 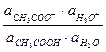 .
.
Ка зависит от Т, но не зависит от концентрации растворенного вещества.
Активность растворителя (воды) в разбавленных растворах можно считать постоянной:
Ка ×  = Кд =
= Кд = 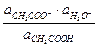 .
.
Величина Кд называется термодинамической константой диссоциации (или просто константой диссоциации).
Заменив активности произведениями аналитических концентраций на соответствующие коэффициенты активности, получим
Кд = 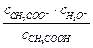 ×
× 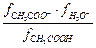 = Кс ×
= Кс × 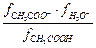 ,
,
где Кс - классическая константа диссоциации.
Для точных расчетов ионных равновесий необходимо пользоваться термодинамической константой диссоциации Кд . Коэффициенты активности можно рассчитать по уравнениям Дебая – Гюккеля. Согласно теории Дебая – Гюккеля, отличие активности от концентрации обусловлено только кулоновским взаимодействием, поэтому для незаряженных частиц СН3СООН 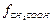 = 1 и, следовательно,
= 1 и, следовательно,
Кд = Кс × 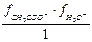 = Кс ×
= Кс × 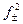 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 319; Нарушение авторских прав?; Мы поможем в написании вашей работы!