
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродный потенциал
|
|
|
|
Электродный потенциал. Водородная шкала потенциалов. Формула Нернста. Стандартный электродный потенциал
Одна из основных особенностей электрохимической системы состоит в пространственном разделении участников протекающей в ней реакции. Общая реакция распадается здесь на две частные реакции, каждая из которых совершается на отдельном электроде. В соответствии с этим ЭДС электрохимической системы также должна представлять собой сумму двух электродных потенциалов: Е = Е1 + Е2 .
Скачок потенциала на границе электрод – раствор (как и разность потенциалов между двумя точками, находящимися в различных фазах) экспериментально измерить невозможно. Величина такого скачка потенциала может быть рассчитана теоретически, но лишь в том случае, если точно известно строение границы раздела двух фаз. Структура границы между электродом и раствором изучена до сих пор недостаточно.
Экспериментально можно измерить лишь общее значение ЭДС цепи, то есть только сумму электродных потенциалов. Для устранения неопределённости величин Е необходимо ввести дополнительное условие - принять потенциал какого-либо электрода равным нулю и относить к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной шкале и их значения зависят от природы электрода, выбранного за основу шкалы.
Нернст предложил считать условным нулём потенциал водородного электрода при концентрации водородных ионов в растворе, равной 1, и давлении газообразного водорода 1 атм. Эта условная шкала потенциалов называется водородной шкалой. В настоящее время применяется главным образом условная водородная шкала, в которой при всех температурах за ноль выбран потенциал стандартного водородного электрода. Она отличается от первоначальной водородной шкалы Нернста тем, что в ней вместо единичных концентраций и давления выбраны единичная активность и летучесть. Это условие позволяет определять потенциалы электродов в водородной шкале при любых Т, однако при каждой Т потенциал водородного электрода может быть иным, то есть условный нуль не будет одним и тем же при разных Т.
Таким образом, электродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева), например:
(+) Pt ïH2 ç H+, aq çç Zn2+ ç Zn (-)
ЭДС этого элемента (ЕZn2+çZn) отрицательна (– 0,763 В при активности ионов цинка в растворе, равной 1; это и есть стандартный электродный потенциал цинка). Чтобы найти электродный потенциал меди, нужно составить элемент
(-) Pt ïH2 ç H+, aq çç Cu2+ ç Cu (+)
Здесь ЭДС цепи (ЕCu2+çCu) положительна (+ 0,337 В при активности ионов меди, равной 1, - стандартный электродный потенциал меди).
Целесообразно в схеме полуэлемента записывать сочетание электрод + раствор иона в том порядке, который имеется в записи элемента, составленного из стандартного водородного электрода и данного; именно для записанного таким образом электрода следует приводить электродный потенциал с соответствующим знаком. При обратной записи следует изменить знак потенциала, например:
(1) Zn2+, aq çZn, Е = - 0,763 B; (2) Zn çZn2+, aq, Е = + 0,763 B.
Только первый тип записи приводит к тем знакам величин Е, которые соответствуют электродным потенциалам. Величины, соответствующие записи (2), не следует называть электродными потенциалами, но ими можно пользоваться при подсчете ЭДС цепи (для электродов, расположение которых в схеме цепи является обратным расположению их в сочетании с водородным электродом), например:
(-) Zn çZn2+, aq çCu2+, aq ç Cu (+)
+ 0,763 В + 0,337 В
Е = Е1 + Е2 = 0,763 + 0,337 = 1,110 В.
Диффузионный потенциал, возникающий на границе растворов ZnSO4 - CuSO4, усложняет расчет.
Диффузионный потенциал возникает на границе двух растворов, отличающихся друг от друга и качественно, и количественно. Причина его возникновения - неодинаковая подвижность ионов электролита и наличие градиента их концентрации.
На границе двух растворов имеется некоторый переходный слой, где состав меняется от раствора I до раствора II и от раствора II до раствора I; в этом переходном слое локализуется диффузионный потенциал. Ионы, обладающие большей подвижностью, диффундируют в более разбавленный раствор с большей скоростью, и поверхность соприкосновения двух растворов заряжается знаком этих ионов со стороны более разбавленного раствора и обратным знаком - со стороны концентрированного. Образуется диффузный двойной электрический слой с соответствующим скачком потенциала. Возникающая разность потенциалов будет ускорять движение медленно движущегося иона и замедлять движение быстро движущегося, пока не наступит стационарное состояние, при котором скорости диффундирующих ионов сравняются. Дальнейшее взаимное удаление зарядов прекращается; установившаяся в пограничном слое разность потенциалов и носит название диффузионного потенциала.
Диффузионный потенциал - неравновесный. Точно его рассчитать в общем случае невозможно.
При измерениях невысокой точности можно существенно снизить диффузионный потенциал на границе двух растворов, включив между ними солевой мостик - концентрированный электролит (насыщенный KCl или NH4NO3) с числами переноса ионов, близкими к 0,5. Резкое уменьшение диффузионного потенциала в этом случае связано с тем, что ионы концентрированного раствора проводят практически весь ток в зонах соприкосновения; один диффузионный потенциал заменяется при введении солевого мостика двумя потенциалами меньшей величины, часто противоположными по знаку. С этой же целью используется введение индифферентной соли во все растворы цепи.
Зависимость величины электродного потенциала от концентрации (активности) вещества в электролите может быть установлена методами термодинамики. На электроде М n + çМ с равновесным потенциалом Е протекает электрохимическая реакция
М n +, aq + ne = М.
Это реакция дегидратации иона металла и включения его в кристаллическую решетку.
Для равновесного процесса при постоянных р и Т убыль изобарного потенциала равна максимальной полезной работе А¢ - работе электрического тока:
А¢ = - DG = n FЕ.
При переходе 1 г-иона металла из раствора в электрод изменение изобарного потенциала равно разности химических потенциалов вещества в двух фазах: в растворе (m¢) и в электроде (m¢¢):
DG = m+¢¢ - m+¢.
При р,Т = const в электроде неизменного состава (чистый металл)
m+¢¢ = m+о = const;
в растворе
m+¢ = m+¢о + RT ln a+,
m+¢о - химический потенциал иона в растворе в стандартном состоянии; эта величина при заданной температуре постоянна.
DG = m+o - m+¢o - RT ln a +,
Е = - (m+o - m+¢o) / n F + 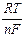 ln a +.
ln a +.
Первый член правой части уравнения при постоянных р и Т - величина постоянная (для металлического электрода эта величина практически не зависит от давления). Можно обозначить ее символом Ео :
Е = Ео + 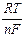 ln a +. (1)
ln a +. (1)
В разбавленном растворе вместо активностей можно подставить концентрации (а + ® m +, c +, N +) в зависимости от выбора меры концентрации и соответственно стандартного состояния для активности, например:
Е = Ео + 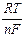 ln m +. (2)
ln m +. (2)
Уравнение (2) было выведено Нернстом (1888) иным путем. Это уравнение, а также более общее уравнение (1) носит название уравнения электродного потенциала Нернста.
Ео - это потенциал электрода относительно раствора с активностью соответствующих ионов, равной 1. Он называется стандартным электродным потенциалом и зависит от температуры.
Е = Ео + 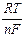 ln a + = Ео +
ln a + = Ео + 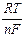 ln m + g¢+ @ Ео +
ln m + g¢+ @ Ео + 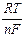 ln m + g¢±.
ln m + g¢±.
Подставляя значение F и переходя от натуральных логарифмов к десятичным, получаем для n = 1 и Т = 298 К
Е = Ео + 0,0591 lg m + g¢±.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 763; Нарушение авторских прав?; Мы поможем в написании вашей работы!