
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стандартный электродный потенциал
|
|
|
|
Значение стандартного электродного потенциала не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного электрода. Стандартные потенциалы (табличные величины) отнесены к 25оС; их значения при других температурах могут быть найдены по температурным коэффициентам, также сведенным в таблицу.
Стандартные потенциалы используются при решении многих проблем, связанных с химическим равновесием в растворах.
Любой электрод, расположенный ниже в ряду стандартных электродных потенциалов (то есть более положительный), находится в более окисленном состоянии, чем электрод, расположенный выше (пример: элемент Даниэля – Якоби). Если из двух таких электродов составить электрохимическую систему, то на «нижнем» будет протекать реакция восстановления (Cu), а на «верхнем» - реакция окисления (Zn). Процесс идет в том же направлении, если активные вещества обоих электродов находятся в непосредственном контакте друг с другом, и реакция протекает по химическому пути. Равновесие в системе наступит в тот момент, когда потенциалы двух электродных реакций сделаются одинаковыми. Такое состояние достигается при определенном соотношении активностей участников реакции, отвечающем константе ее равновесия.
Приведем примеры. Пусть взяты редокси – системы Се3+, Се4+ и Fe2+, Fe3+. Электродный потенциал первой системы при 25оС описывается уравнением
 = 1,61 + 0,059 lg
= 1,61 + 0,059 lg 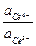 ,
,
а электродный потенциал второй -
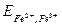 = 0,77 + 0,059 lg
= 0,77 + 0,059 lg 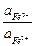 .
.
Равновесие в системе, содержащей ионы церия и железа, установится, когда их потенциалы будут одинаковыми:
1,61 + 0,059 lg 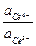 = 0,77 + 0,059 lg
= 0,77 + 0,059 lg 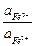 .
.
Следовательно, в состоянии равновесия
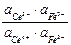 =
= 
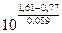 = 1014.
= 1014.
При добавлении к раствору, содержащему ионы Fe2+ и Fe3+, раствора, содержащего ионы Се3+ и Се4+, реакция будет протекать в сторону окисления ионов Fe2+ и восстановления ионов Се4+; в состоянии равновесия железо будет практически полностью окислено до ионов Fe3+, а церий восстановлен до ионов Се3+. Высокий окислительный потенциал системы Се3+, Се4+ дает возможность использовать ее в химическом объемном анализе (цериметрия).
Подобная же картина наблюдается при смешении растворов Fe2+, Fe3+ и Sn2+, Sn4+, когда железо восстанавливается, а олово окисляется. В равновесном состоянии, как это следует из стандартных потенциалов,
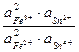 =
= 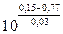 = 10–20,7,
= 10–20,7,
почти все растворенное железо будет присутствовать в форме ионов Fe2+. Растворы солей олова (II) применяются поэтому для количественного восстановления ионов Fe3+ до ионов Fe2+ и при проведении ряда других реакций восстановления.
Аналогичные явления лежат в основе процесса вытеснения металлов из растворов их солей другими металлами, расположенными ближе к началу ряда стандартных электродных потенциалов. Этот процесс называется цементацией или контактным вытеснением и широко используется в технике. На практике часто встречаются случаи контактного вытеснения меди железом из растворов ее простых солей. Здесь, как это следует из значений стандартных потенциалов, в состоянии равновесия
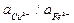 = 10–26.
= 10–26.
Следовательно, если с раствором соли меди контактирует достаточное количество металлического железа, то процессы растворения железа и осаждения меди будут продолжаться до тех пор, пока отношение активностей их ионов не начнет удовлетворять вышеприведенному уравнению (раствор практически полностью освобожден от ионов Cu2+).
Если электроды расположены в ряду стандартных электродных потенциалов близко друг к другу, как, например, Sn2+, Sn4+ и Cu+, Cu2+, то константа равновесия редокси – реакции мало отличается от 1, и при смешении растворов, содержащих такие редокси – пары, окислительно-восстановительное равновесие смещается не очень заметно.
Большинство электрохимических процессов протекает в контакте с водой и воздухом. Поэтому особенно важным, с практической и теоретической точек зрения, является положение данного электрода в ряду стандартных электродных потенциалов относительно электродов H+ êH2 êPt и OH– êO2 êPt.
Все электроды с потенциалом более отрицательным, чем потенциал водородного электрода, в водных растворах термодинамически неустойчивы. Реакции, отвечающие таким электродам, должны протекать самопроизвольно в сторону получения более окисленных веществ с одновременным разложением воды и выделением из нее газообразного водорода. Так, например, металлический натрий ( = - 2,71 В) должен разлагать воду и переходить в ионное состояние по уравнению
= - 2,71 В) должен разлагать воду и переходить в ионное состояние по уравнению
Na + H2O = Na+ + 1/2 H2 + OH– 
Точно так же, поскольку стандартный потенциал редокси-системы Ti2+, Ti3+ значительно отрицательнее потенциала водородного электрода ( = - 0,37 В), в водных растворах солей титана (II) должно самопроизвольно протекать окисление ионов Ti2+ до ионов Ti3+ с одновременным разложением воды:
= - 0,37 В), в водных растворах солей титана (II) должно самопроизвольно протекать окисление ионов Ti2+ до ионов Ti3+ с одновременным разложением воды:
Ti2+ + Н2О = Ti3+ + 1/2 Н2 + ОН–
или, в кислых средах,
Ti2+ + Н+ = Ti3+ + 1/2 Н2
Все электроды, потенциалы которых менее положительны, чем потенциал кислородного электрода, термодинамически неустойчивы в контакте с воздухом и водой. В этих случаях наблюдается самопроизвольное восстановление кислорода и превращение его в воду (или в пероксид водорода) с одновременным окислением соответствующих металлов или других веществ. Так, например, металлическое железо (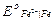 = - 0,44 В) реагирует с кислородом воздуха:
= - 0,44 В) реагирует с кислородом воздуха:
Fe + 1/2 O2 + H2O = Fe2+ + 2OH–
Ионы Cu+ ( = + 0,154 В) также самопроизвольно окисляются в растворе до ионов Cu2+:
= + 0,154 В) также самопроизвольно окисляются в растворе до ионов Cu2+:
Cu+ + 1/4 O2 + 1/2 H2O = Cu2+ + OH–
Металлическая медь (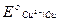 = + 0,34 В) переходит в состояние двухвалентных ионов:
= + 0,34 В) переходит в состояние двухвалентных ионов:
Cu + 1/2 O2 + H2O = Cu2+ + 2OH–
Таким образом, если электрод расположен в ряду стандартных электродных потенциалов между водородным и кислородным электродами, то при его контакте с раствором разложение воды с выделением водорода будет термодинамически невероятно. Однако остается возможной реакция восстановления кислорода, поэтому такой электрод должен быть термодинамически неустойчив в присутствии воды и воздуха. Если же водный раствор обезгазить и воздух над ним заменить инертной атмосферой, тогда восстановление кислорода будет исключено и электрод станет термодинамически устойчивым. В этих условиях можно реализовать обратимый потенциал электрода и измерить его относительно соответствующего электрода сравнения.
Электроды с потенциалами более положительными, чем у равновесного кислородного электрода, термодинамически неустойчивы и должны разлагать воду с выделением газообразного кислорода. Например, судя по стандартному потенциалу системы Се4+, Се3+ (+ 1,61 В), ионы Се4+ в водных растворах должны самопроизвольно восстанавливаться с одновременным разложением воды и образованием кислорода:
Се4+ + 1/2 Н2О = Се3+ + 1/4 О2 + Н+
Лекция 56
Классификация электродов. Электроды первого и второго рода. Электроды сравнения. Газовые электроды. Амальгамные электроды. Окислительно-восстановительные электроды, правило Лютера. Хингидронный электрод, измерение рН
Классификация электродов
Если на электроде протекает частная реакция
nA A +... + nF = nL L +...,
то потенциал электрода определяется уравнением
E = Eо + 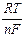 ln
ln  ,
,
то есть при заданных Т и р определяется (кроме Eо, который является константой) активностями веществ, участвующих в электродной реакции. Характер влияния активностей компонентов раствора на значение E связан с природой электродной реакции и лежит в основе классификации электродов. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1257; Нарушение авторских прав?; Мы поможем в написании вашей работы!