
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрационные цепи
|
|
|
|
КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ПЕРВОГО РОДА. К концентрационным цепям первого рода относят системы, состоящие из двух электродов, одинаковых по своей природе, но отличающихся по количественному составу; оба электрода погружены в один и тот же раствор. Концентрационные цепи первого рода – цепи без переноса, так как содержат всего один раствор.
Типичным примером концентрационных цепей являются амальгамные цепи, в которых отличие между электродами сводится лишь к неодинаковой активности металла, растворенного в амальгаме:
Hg, M êMA êM, Hg
(a I) > (a II)
Если a I > a II, то на левом электроде металл растворяется и переходит в раствор в виде ионов
MHg (a I) = M n + + ne + Hg,
а на правом электроде совершается та же реакция, но в обратном направлении:
M n + + ne + Hg = MHg (a II).
Суммарный процесс сводится к переносу металла от концентрированной амальгамы к разбавленной:
MHg (a I) ® MHg (a II)
ЭДС такой системы равна
Е = 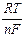 ln
ln 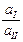 .
.
Перенос происходит до тех пор, пока сохраняется различие в концентрациях (активностях) амальгам, использованных в качестве электродов.
Примером амальгамной цепи служит элемент, изготовленный из амальгам калия разной активности и раствора хлорида калия:
Hg, K êKCl êK, Hg
(a I) > (a II)
Другим примером концентрационных цепей первого рода служат простые газовые цепи, составленные из двух одинаковых газовых электродов, отличающихся лишь давлением газа. ЭДС таких систем можно найти из механической работы, совершаемой при переходе 1 моля газа от высокого давления р ¢ к низкому р ¢¢:
Е = 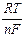 ln
ln  .
.
Например, ЭДС водородной газовой цепи
Pt êH2 êHCl êH2 êPt
( ) > (
) > (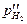 )
)
определяется уравнением
Е = 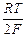 ln
ln 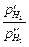 .
.
На левом электроде будет наблюдаться ионизация водородного газа, а на правом - разряд водородных ионов и переход водорода в газовую фазу. Из уравнения для ЭДС следует, что для газов типа водорода и хлора с n = 2 ЭДС газовой цепи при отношении р ¢/ р ¢¢ = 10 и при 25оС составит около 0,030 В. Для кислородной газовой цепи (n = 4) при тех же условиях ЭДС равна 0,015 В.
КОНЦЕНТРАЦИОННЫЕ ЦЕПИ ВТОРОГО РОДА. Эти цепи включают в себя два одинаковых электрода, погруженных в растворы одного и того же электролита различной активности. В зависимости от того, по отношению к каким ионам электролита обратимы электроды, концентрационные цепи второго рода разделяются на катионные, например
I II
Hg, K êKCl¦KCl êK, Hg
(a I) < (a II)
и на анионные, например
Ag êAgCl êHCl¦HCl êAgCl êAg
(a I) > (a II)
Процесс, вызывающий появление ЭДС в цепях такого рода, заключается в переносе электролита из концентрированного раствора в разбавленный; концентрационные цепи второго рода относятся к цепям с переносом. Существование между растворами границы, через которую совершается перенос ионов и где локализуется диффузионный потенциал, позволяет определять их также как цепи с жидкостной границей.
Рассмотрим процесс образования ЭДС в концентрационных цепях второго рода на примере анионной цепи. Пусть a I > a II, тогда у левого электрода будет протекать реакция
Ag + Cl–I = AgCl + e
и совершаться перенос ионов в соответствии с их числами переноса
- t + H+I + t - Cl–I.
У правого электрода будут протекать те же процессы, но в обратном направлении: во-первых, превращение хлорида серебра в металлическое серебро и ионы хлора
AgCl + e = Ag + Cl–II
и, во-вторых, перенос ионов
t+ H+II - t - Cl–II.
Сумма всех электродных процессов дает общее уравнение электрохимической реакции в анионной цепи
t + H+I + t + Cl–I = t + H+II + t + Cl–II.
Таким образом, источником электрической энергии в данной концентрационной цепи является перенос t + молей HCl от более концентрированного раствора к менее концентрированному. Выражение для ЭДС анионной концентрационной цепи второго рода имеет вид
Е = Ео + 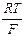 ln
ln 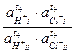 = t +
= t + 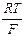 ln
ln  ,
,
поскольку Ео = Eо1 + Eо2 = 0 для системы с двумя одинаковыми электродами, включенными навстречу друг другу.
Свяжем активность отдельных ионов электролита с его средней активностью:
а + а - = а ±2.
Тогда Е = 2 t + 2,303 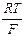 lg
lg  .
.
Аналогично выводится уравнение для ЭДС катионной концентрационной цепи второго рода. Так, для вышеприведенной амальгамной цепи
Е = – 2 t – 2,303 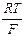 lg
lg  .
.
Из уравнений следует, что, измерив ЭДС цепи с переносом при различных концентрациях электролита, можно найти числа переноса образующих его ионов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2712; Нарушение авторских прав?; Мы поможем в написании вашей работы!