
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические цепи
|
|
|
|
Химические цепи принято разделять на простые и сложные. В простых химических цепях один из электродов обратим по отношению к катионам электролита, а другой - к его анионам. В сложных химических цепях это условие не соблюдается.
ПРОСТЫЕ ХИМИЧЕСКИЕ ЦЕПИ. В водородно-кислородном элементе
М1 êН2 êН2О êО2 êМ2
источником электрической энергии служит химическая энергия реакции между кислородом и водородом с образованием воды:
Н2 + 1/2 О2 = Н2О.
Выражение для ЭДС водородно-кислородного элемента имеет вид
Е = Ео + 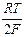 ln
ln  .
.
К этому же уравнению можно прийти, рассмотрев частные электродные реакции. На водородном электроде протекает реакция ионизации водорода
Н2 = 2Н+ + 2 е,
а на кислородном - реакция ионизации кислорода с образованием гидроксильных ионов
1/2 О2 + Н2О + 2 е = 2ОН–.
Сумма электродных реакций дает общую реакцию в химической цепи
Н2 + 1/2 О2 + Н2О = 2Н+ + 2ОН–;
Е = Ео¢ + 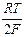 ln
ln 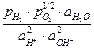 .
.
Преобразуем выражение, положив  = 1 и учтя, что
= 1 и учтя, что  = Kw:
= Kw:
Е = Ео¢ -  ln Kw +
ln Kw + 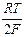 ln
ln  .
.
Полученное выражение совпадает с вышеприведенным выражением для ЭДС при
Ео = Ео¢ -  ln Kw.
ln Kw.
При 25оС Ео = 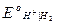 +
+ 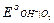 -
-  ln Kw =
ln Kw =
= 0 + 0,401 - 0,059 lg 10-14 = 0,401 + 0,829 = 1,230 В;
Е = 1,230 + 0,03 lg  .
.
Видно, что ЭДС водородно-кислородного элемента зависит от парциальных давлений водорода и кислорода, увеличиваясь с их ростом по логарифмическому закону. Она не зависит от рН среды и должна быть одной и той же в чистой воде и в растворах щелочи или кислоты. Так как электропроводность чистой воды очень низка, то на практике применяют растворы щелочи, чаще всего раствор КОН:
М1 êН2 êКОН êО2 êМ2.
Другим примером простых химических цепей может служить стандартный элемент Вестона
Pt êHg, Cd êCdSO4 êHg2SO4 êHg êPt,
ЭДС которого отличается очень большим постоянством во времени и малым температурным коэффициентом. В элементе Вестона левый электрод обратим по отношению к ионам кадмия
Cd = Cd2+ + 2 e,
а правый - по отношению к сульфат-ионам
Hg2SO4 + 2 e = 2Hg + SO42–.
Общая реакция, протекающая в элементе:
Cd + Hg2SO4 = Cd2+ + SO42– + 2Hg.
При учете постоянства активностей твердых веществ ЭДС элемента Вестона описывается уравнением
Е = Ео - 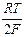 ln
ln  = Ео -
= Ео -  ln
ln 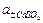 .
.
Следовательно, его ЭДС определяется активностью раствора сульфата кадмия. В электрохимической практике для измерения ЭДС компенсационным методом чаще всего применяют элементы Вестона с насыщенным раствором CdSO4. Амальгамный электрод в таком элементе содержит 12,5% кадмия. ЭДС насыщенного элемента Вестона при Т, близкой к комнатной, находят по уравнению
E t = 1,0183 - 4,0×10–5 (t - 20).
Третьим примером простых химических цепей может служить свинцовый, или кислотный, аккумулятор (см. ниже, «Аккумуляторы»).
Простые химические цепи – цепи без переноса. Однако подавляющее большинство химических цепей – это цепи с переносом, в которых растворы соединены или непосредственно, или через солевой мостик. Комбинируя различные окислительно-восстановительные полуреакции, можно построить очень большое число химических цепей. Разность соответствующих стандартных потенциалов позволяет в первом приближении оценить ЭДС этих цепей. Точное значение ЭДС химических цепей с переносом рассчитать не удается, во-первых, из-за невозможности точного определения диффузионного потенциала, и во-вторых, из-за неизбежной замены активностей отдельных ионов в формуле Нернста средними активностями или просто концентрациями этих ионов.
СЛОЖНЫЕ ХИМИЧЕСКИЕ ЦЕПИ. Примером сложных химических цепей является элемент Даниэля – Якоби
Zn êZnSO4¦CuSO4 êCu,
в котором протекает реакция
Zn + Cu2+ = Zn2+ + Cu.
Левый электрод - отрицательный полюс элемента - обратим по отношению к ионам цинка, а правый - положительный полюс элемента - по отношению к ионам меди. ЭДС элемента Даниэля – Якоби зависит поэтому от отношения активностей ионов меди и цинка:
Е = Ео + 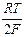 ln
ln 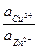 .
.
В этом элементе имеется граница между двумя растворами, на которой возникает диффузионный потенциал, поэтому ЭДС элемента в действительности сложнее. Однако, поскольку подвижности ионов меди и цинка не слишком отличаются друг от друга и концентрации сульфата меди и цинка близки между собой, диффузионный потенциал не играет существенной роли в создании ЭДС этого элемента.
СДВОЕННЫЕ ХИМИЧЕСКИЕ ЦЕПИ. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностью электролита, имеют один общий электрод и, таким образом, электрически соединены через проводник первого рода в единую цепь. Например, простые цепи с хлоридсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом
I II
Ag êAgCl êHCl êH2 êPt êH2 êHCl êAgCl êAg
(a I) > (a II)
В каждой из двух ячеек цепи протекает одна и та же реакция
Ag + H+ + Cl– = AgCl + 1/2 H2
но в противоположных направлениях, причем если a I > a II, то в первой ячейке реакция идет слева направо, а во второй - справа налево:
Ag + H+I + Cl–I = AgCl + 1/2 H2
AgCl + 1/2 H2 = Ag + H+II + Cl–II
Суммарный процесс эквивалентен переносу 1 моль ионов водорода и 1 моль ионов хлора из первой ячейки во вторую
H+I + Cl–I = H+II + Cl–II,
хотя фактический перенос в этой системе из-за отсутствия непосредственной границы раздела между растворами исключен и изменение содержания HCl обусловлено не переносом ионов, а химическими реакциями, протекающими в цепи. Сдвоенные химические цепи являются поэтому цепями без переноса или цепями без жидкостной границы. На основании уравнения реакции ЭДС системы будет равна
Е = Ео +  ln
ln  = 2
= 2  ln
ln  ,
,
причем стандартная ЭДС Ео равна 0, так как в обеих ячейках протекает одна и та же реакция, но в противоположных направлениях. При этом на одной стороне водородного электрода (общего для обеих ячеек) совершается катодный процесс Н+ + е = 1/2 Н2, а на другой - анодный 1/2 Н2 = Н+ + е. Подобные электроды называются биполярными и широко используются электрохимической промышленностью.
И по характеру процесса, и по форме уравнения для ЭДС двойная химическая цепь напоминает концентрационные цепи второго рода. Однако в сдвоенных химических цепях нет диффузионного потенциала и связанных с ним осложнений. Сопоставление ЭДС сдвоенной химической цепи и ЭДС концентрационной цепи с переносом с тем же электролитом позволяет определить его числа переноса. Сопоставление ЭДС двойной химической цепи с ЭДС соответствующей его простой цепи дает возможность с большой точностью находить стандартные потенциалы их электродов и коэффициенты активности электролитов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2867; Нарушение авторских прав?; Мы поможем в написании вашей работы!