
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение коэффициентов активности электролитов
|
|
|
|
Измерение ЭДС как метод физико-химического исследования: определение коэффициентов активности, рН, произведения растворимости. Потенциометрия. Ион-селективные электроды
Измерение ЭДС различных цепей является удобным методом избирательного нахождения коэффициентов активности отдельных солей в растворах сложного состава и изучения взаимного влияния компонентов сложного электролита на их активности. Примером может служить сдвоенная химическая цепь без переноса, рассмотренная выше:
I II
Ag êAgCl êHCl êH2 êPt êH2 êHCl êAgCl êAg
(a I) > (a II)
Растворенная кислота HCl переносится здесь из раствора I в раствор II не непосредственно, а в результате протекания двух противоположно направленных электрохимических реакций. Для нахождения а ± необходимо использовать предельное условие, по которому а ± ® m ± при m ® 0 (или g± ® 1 при m ® 0). Для простоты примем z+ = z- = 1 и m ± = m. Проведем измерения ЭДС в серии цепей, при которых m I (то есть a ±I) - величины постоянные, а m II (a ±II) систематически изменяются в сторону понижения.
Преобразуем выражение для ЭДС цепи без переноса, подставив a ±II = m II×g±II и собрав в левой части измеримые величины (Е и m II):
Е + 2  ln m II = 2
ln m II = 2  ln a ±I - 2
ln a ±I - 2  ln g±II.
ln g±II.
По мере уменьшения m II значение ln g±II приближается к 0. Следовательно, при m II ® 0
lim (Е + 2  ln m II) = 2
ln m II) = 2  ln a ±I.
ln a ±I.
При 25оС lim (Е + 0,118 lg m II) = 0,118 lg a ±I.
Для нахождения a ±I следует графически экстраполировать величину, стоящую в скобках, как функцию m при m ® 0. Удобно воспользоваться тем, что при малых концентрациях ln g±II линейно зависит от 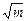 . Поэтому, изображая графически зависимость Е + 0,118 lg m II от
. Поэтому, изображая графически зависимость Е + 0,118 lg m II от 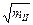 , получим при достаточно малых m прямую, которая легко экстраполируется к m ® 0, что позволяет определить величину a ±I для электролита постоянного состава.
, получим при достаточно малых m прямую, которая легко экстраполируется к m ® 0, что позволяет определить величину a ±I для электролита постоянного состава.
Зная ln a ±I, можно из вышеприведенного уравнения найти ln g±II любого раствора в изученном интервале концентраций по измеренным Е и m II:
0,118 lg g±II = 0,118 lg a ±I - (Е + 0,118 lg m II).
Если z+ и z- не равны 1, то получаем (при 25оС)
lim (E +  0,059 lg m II) =
0,059 lg m II) =  0,059 lg a ±I.
0,059 lg a ±I.
Для измерения этим методом коэффициентов активности растворов соединений щелочных металлов (NaCl, K2SO4, LiOH...) приходится применять вместо водородного электрода электрод из амальгам щелочных металлов в комбинации с серебряным или ртутным электродами в насыщенных растворах соответствующих соединений серебра (AgCl, Ag2SO4, Ag2O) или ртути.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 695; Нарушение авторских прав?; Мы поможем в написании вашей работы!