
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ион-селективные электроды
Анализируя различные типы ион-селективных электродов следует в первую очередь упомянуть о рН-электродах. Измерение рН (величины, равной отрицательному логарифму концентрации протонов в рвстворе) является одной из наиболее часто встречающихся процедур электрохимического анализа в химических или биохимических лабораториях. рН-электрод в сочетании с высокоомным (входное сопротивление порядка 1015 Ом) усилителем-вольтметром или, как его называют в подобной практике, рН-метром, является исключительно важным аналитическим прибором, позволяющим выполнять множество различных измерений – контролировать значение рН растворов, регистрировать изменение рН в ходе реакций, производить измерение разности потенциалов с высокой точностью. рН-электрод и метод измерения концентрации протонов был введен в практику химических измерений в начале 20-го века. К настоящему времени создано значительное количество разнообразных ИСЭ для детекции катионов Na+, K+, Mg2+, Ca2+, Cd2+, Cu2+, Ag2+, NH4+; анионов S-, I-, Br-, CN-, SCN-, F-, NО3-, ClO4-.
В общем виде выражение для потенциала E, возникающего на мембране ИСЭ, описывается уравнением Никольского:
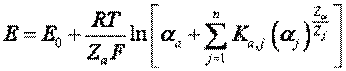
где Е – генерируемый потенциал, мВ. Е0 – постоянный потенциал, не связанный с измеряемым ионом, αa – активность основного измеряемого иона, имеющего валентность zа. αj, zj, Ka,j – активность, валентность и селективность ИСЭ для каждого типа иона, вносящего помеху в измерения. R - газовая постоянная, равная 8,3 Дж/моль.град; Т - абсолютная температура, градусы; F - число Фарадея, 96 кКл/моль; логарифм десятичный.
На практике для оценки потенциала, возникающего на мембране ИСЭ, вместо уравнения Никольского часто используют уравнение Нернста, представляющего частный случай уравнения Никольского. Уравнение Нернста описывает упрощенную модель генерации потенциала, в которой не учитывается мешающее влияние других ионов, т.е. уравнение Нернста рассматривает ситуацию абсолютной селективности ИСЭ к данному типу иона. Уравнение Нернста имеет вид: Е = (2.3RT/zF) lg (С1/С2). Подразумевается, что С1 – концентрация иона в измеряемом растворе, С2 – концентрации иона внутри ИСЭ.
Одним из наиболее важных параметров, характеризующих ИСЭ, является чувствительность. Как и для любой измерительной системы, чувствительность выражается отношением изменения выходной функции к изменению параметра, от которого она зависит. В случае ИСЭ чувствительность определяют как отношение DЕ/D lg (С1/С2) на участке линейной зависимости. Естественно, что интерес представляет максимальное значение чувствительности. По сути это максимальное значение соответствует максимальному значению производной от Е по lg (С1/С2). Чувствительность электрода, поведение которого описывается уравнением Нернста, можно выразить отношением изменения потенциала к десятикратному изменению концентрации иона. Для одновалентных ионов (в том числе и для протона) теоретическая величина этого параметра равна величине коэффициента 2.3RT/zF и составляет 59 мВ при изменении концентрации протонов в десять раз (или при изменении рН единицу, поскольку по определению, рН = - lg [H+], где [H+] представляет концентрацию протонов).
|
|
Дата добавления: 2014-01-07; Просмотров: 591; Нарушение авторских прав?; Мы поможем в написании вашей работы!