
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия активации всего процесса будет равна энергии активации более медленной, т.е. более эндотермической стадии
|
|
|
|
На рис. представлено изменение энергий стадий образования и превращения мультиплетного комплекса случаев эндотермической и экзотермической реакций в зависимости от величины адсорбционного потенциала. С ростом q возрастает тепловой эффект первой стадии и уменьшается тепловой эффект второй стадии.
Минимальная энергия активации всей реакции отвечает точке пересечения этих прямых. Из равенства Е1 = Е2 найдем координаты точки пересечения:
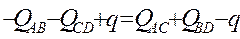 ;
; 
Подставив найденное значение q вуравнение для Е1 найдем вторую координату точки пересения:
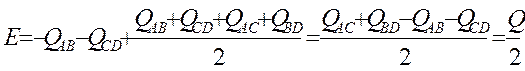
Q – тепловой эффект реакции.
Ординаты точек сплошной линии, взятые с обратным знаком, равны энергии активации реакции. Минимальная величина энергии активации отвечает точке пересечения и равна половине отрицательного теплового эффекта реакции.
Минимум энергии активации, а следовательно максимум скорости реакции отвечает оптимальному значению адсорбционного потенциала:

Как большие, так и меньшие значения энергии взаимодействия с катализатором приводят к росту энергии активации и уменьшению скорости реакции.
В дальнейшем Баландин пришел к выводу, что действительная энергия активации ниже – эндотермичености стадий образований или превращения мультиплетного комплекса вследствие того, что связи A – D и C – D не разрываются полностью при его образовании. По аналогии с уравнением Брентседа–Поляни он полагает, что энергия активации

Несколько сложнее обстоит дело для экзотермических реакций. В этом случае точка пересечения линий Е1 и Е2 лежит выше оси абсцисс. Поскольку отрицательные значения энергии активации лишены физического смысла, Баландин полагает, что для всех точек, расположенных выше оси абсцисс, энергия активации = 0. Тогда энергии активации равны ординатам точек линии lmno, взятым с обратным знаком. Оценить энергию активации можно лишь для малых и больших адсорбционных потенциалов. В интервале mn адсорбционные потенциалы оптимальны и энергии активации равны 0.
Графическая зависимость Е от q представляется следующим образом.
От прямых линий отбираются участки, которые составляют непрерывную ломаную линию, лежащую ниже оси абсцисс, получаем вулканообразные кривые для эндо – и экзотермических реакций. Фиксация q определяет секущую, точка пересечения которой с ломаной линией и задает высоту энергетического барьера для данной реакции и данного катализатора. Положение секущей и значение q определяется природой катлизатора.
Перемещение секущей слева направо постепенно увеличивает адсорбционный потенциал q. Сначала Е убывает, достигает минимума и возрастает, соответственно скорость увеличивается, достигает максимума и уменьшается, т. е. каталитическая активность как функция q проходит через максимум, т.е. каталитическая реакция с максимальной скоростью будет осуществляться при некоторых оптимальных значениях q.
Таким образом образом, согласно Баландину, выбор оптимального катализатора сводится к сопоставлению величин Е1 и Е2 с Q/2, а также к сравнению геометрических параметров реагирующих молекул со структурными характеристиками катализатора. Для осуществления конкретных расчетов необходимо знать строение мультиплетных комплексов и располагать значениями энергий связей, требуемыми для вычисления q1 и q2, q.
Рекомендуется поступать следующим образом. В реагирующих молекулах выделяют группу атомов, непосредственно связанных с активным центром катализатора – так называемую индексную группу. Остальные атомы образуют внерамочные заместители. Предполагается, что основной вклад в величину q дают энергии связей атомов индексной группы с катализатором, внерамочные заместители оказывают малое влияние на q, имеющее характер поправки.
Для большого числа органических реакций Баландин составил каталог предполагаемых индексных групп. По существу эти индексные группы изображаются таким образом, что расположение в них реагирующих атомов позволяет простейшим путем перейти к конечным продуктам. Разработаны методы оценки энергий связей катализаторов с различными атомами, образующими органические соединения.
Недостатки теории:
1. Условие q1 = q2 = Q/2 для экзотермических реакций лишено смысла, поскольку в этом случае энергии активации должны быть отрицательны.
Баландин приходит к выводу, что Еакт = 0, но это не согласуется с экспериментальными данными, которые показывают что и для экзотермических реакций наблюдаемая Еакт не может быть приравнена к нулю. Также как и для нетепловых реакций. Это несоответствие связано с ошибочностью предположения Баландина о том, что энергия активации = или составляет некоторую долю от эндотермичности реакции. В действительности, образование активного комплекса связано с затратой энергий как для эндотермических, та и для экзотермических реакций. Это обусловлено затратой энергий на раздвижение атомов и деформацию связей и валентных углов, необходимых для образования активного комплекса.
2. Предложенные мультиплетной теорией схемы протекания каталитических процессов неприменимы к обширному классу окислительно-восстановительных реакций сильно экзотермических (реакций с молекулярным О2). Для таких реакций, как окисление Н2 молекулярным О2 на Pt не применимы и структурные требования теории, т.к. активация молекул Н2 и О2 происходит на участках поверхности, находящихся не по соседству друг с другом.
Обычно мультиплетная теория применялась к реакциям гидрирования….
Однако и для этих реакций схемы рассматриваемой теории часто либо не оправдываются, либо являются большим упрощением. Так, например, гидрирование бензола и дегидрирование циклогексана на Me происходит по механизму, отличающемуся от классической секстетной модели. Идее химического промежуточного взаимодействия приписывали главную роль, а за основу каталитического действия брали не химизм, а структуру.
3. Теория не учитывает и того, что скорость реакции зависит не только от энергии активации, но определяется и энтропией активации.
Химизм, характеризуемый энергией, оказался плодотворнее.
Отмеченные недостатки мультиплетной теории обусловливают весьма ограниченные возможности предвидения каталитического действия на основе данной теории. Вместе с тем нужно отметить большую роль, которую сыграла, несмотря на ее несовершенство, мультиплетная теория в решении проблемы предвидения каталитического действия.
Именно в этой теории был впервые четко поставлен вопрос об оптимальном катализаторе и сформулированы важные принципы энергетического и структурного соответствия.
Оптимальная энергия промежуточного химического взаимодействия реактантов с катализатором.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!