
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концепция теории резонанса (Полинг, 1928 г.)
|
|
|
|
Концепция теории мезомерии.
Графические способы описания делокализации электронов в сопряженных системах.
Делокализацию электронов изображают стрелками.

Представление К. Ингольда о мезомерии вошли как составная часть в теорию резонанса, разработанную в 1928–1938 г. Л. Полингом. Согласно Полингу, молекулу можно описать как быстро флуктуирующую структуру между двумя электронными формулами (резонирующими структурами) и приобретающими стабильность большую, чем любая из формул, благодаря резонансной энергии этой флуктуации. Реальная молекула описывается как "резонансный гибрид", в котором распределение электронной плотности является промежуточным между распределением электронной плотности в резонансных гибридных структурах. Сопряженные системы изображают с помощью набора резонансных структур, объединяемых резонансной стрелкой. Реальная структура есть результат суперпозиции нескольких резонансных структур:

· Бензол может быть изображен пятью резонансными структурами:

· Основные резонансные структуры анилина следующие:

3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).

Концепция мезомерии – резонанса является способом реального электронного строения молекул с помощью граничных структур. Резонансные формулы обладают хорошей наглядностью и позволяют подчеркивать особенности электронной структуры. Дальнейшее развитие представлений о взаимодействии связей и перераспределении электронной плотности в сопряженных молекулах нашло свое воплощение в квантовой органической химии.
Таблица 9 – Соотношение индуктивных и мезомерных эффектов заместителей
| Заместитель | I эффект | М эффект | ЭД - или ЭА - влияние заместителя |
| Алкилы | + I | – | ЭД |
| СН3–, С2Н5– | –I | – | ЭА |
| –ОН | –I | +М | ЭД (+М > –I) |
| –ОСН3 | –I | +М | ЭД (+М > –I) |
| –NH2 | –I | +М | ЭД (+М > –I) |
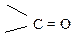
| –I | –М | ЭА |

| –I | –М | ЭА |

| –I | –М | ЭА |

| –I | –М | ЭА |
| –Cl, –Br, –I | –I | + М | ЭА (+М < –I) |
Электронное строение сопряженных систем. Сопряженная система – система sp2 гибридизованных атомов с общим копланарным σ -скелетом с делокализованным π -облаком и обладающая повышенной термодинами-ческой устойчивостью.

Сопряжение –взаимное перекрывание рz -орбиталей нескольких π- или π, р -систем, приводящее к делокализации π -электронного облака и повышению термодинамической устойчивости.
Энергия сопряжения ER (мера термодинамической устойчивости) – разность энергий образования реально существующей сопряженной молекулы и соответствующей молекулы (реальной или гипотетической) с изолированными двойными связями.
· Пентадиен – 1,3 (I) 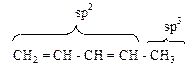

· Пентадиен – 1,4 (II) СН2 = СН – СН2 – СН = СН2

· Бензол

Типы сопряжения. π,π-сопряжение –в сопряжении участвуют π- электроны нескольких π -систем (не менее 4-х центров).

р, π-сопряжение – в сопряжении участвуют π -электроны π -системы и р -электроны на pz -орбитали гетероатома (не менее 3-х центров).

Ароматическая система – замкнутая сопряженная система рz- орбиталей с делокализованными π- или р -электронами, число которых соответствует формуле Хюккеля.
Условия сопряжения. Для ациклических сопряженных систем:
· sp2 гибридизация всех атомов в сопряженном фрагменте;
· копланарность общего σ -скелета, валентный угол 120о.
Для ароматических систем:
· наличие цикла;
· sp2 гибридизация всех атомов в цикле;
· копланарность σ -скелета, отсутствие углового напряжения, валентный угол 120о;
· Число делокализованных электронов должно соответствовать формуле Хюккеля:

где n – целое число; N – число делокализованных электронов.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1311; Нарушение авторских прав?; Мы поможем в написании вашей работы!