
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности ионных и радикальных реакций
|
|
|
|
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ И ПРОМЕЖУТОЧНЫХ ЧАСТИЦ
Химическая реакция – это следствие перераспределения электронов внешних оболочек атомов реагирующих веществ, в результате чего разрушаются одни и возникают новые химические связи.
Компоненты реакции:
· субстрат (с реакционным центром);
· атакующий реагент;
· интермедиат;
· катализатор (или ингибитор);
· конечные продукты реакции.
Химизм реакции – описание реакции с указанием только исходных веществ, конечных продуктов и условия проведения реакции.
Механизм реакции – это реальный путь, по которому протекает реакция. Описываемый в литературе механизм – гипотеза, предлагаемая для объяснения экспериментальных данных.
Движущей силой химических реакций является стремление к образованию новых, обладающих меньшей свободной энергией, и, следовательно, более стабильных систем.
Энергия активации – это избыточное количество энергии, которое необходимо придать исходной системе для преодоления энергетического барьера, чтобы прошла реакция.
Активированный комплекс – создается при сближении молекул, обладает наивысшей свободной энергией.
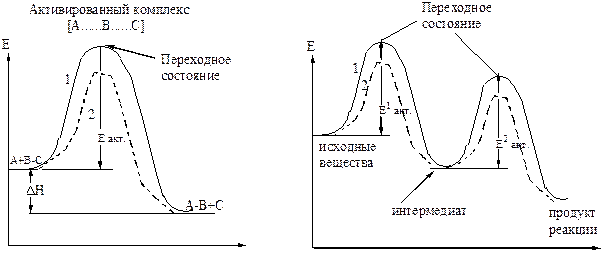
Ход одностадийной реакции Ход двухстадийной реакции
1 – некатализируемая реакция
2 – катализируемая реакция
Рисунок 20 – Энергетическая диаграмма химических реакций
Переходное состояние – участок энергетического профиля реакции, соответствующий энергии активированного комплекса.
Интермедиат – промежуточный продукт многостадийной реакции.
Лимитирующая стадия – определяющая скорость всего много-стадийного процесса, стадия образования интермедиата.
Катализатор – понижает величину энергии активации, увеличивает скорость химической реакции.
Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью.
Органическую химию отличает чрезвычайное разнообразие превращений. Для ориентирования разработана классификация органических реакций по различным признакам. Все органические реакции подразделяют по механизму, направлению, молекулярности, агрегатному состоянию, принадлежности реагента или продуктов к различным классам соединений.
По характеру реагирующих частиц и типу разрыва ковалентной связи реакции могут быть:
· гомолитическими;
· гетеролитическими.
Гомолитические (радикальные реакции) сопровождаются гомолитиче-ским разрывом ковалентной связи. Реагентами в таких реакциях обычно являются радикалы либо молекулы, легко разрушающиеся до радикалов в условиях реакции, или атомы. В условия осуществления гомолитических реакций включают газовую фазу или неполярный растворитель, высокие температуры, воздействие светом или высокой энергией.
Гетеролитические (ионные, полярные) реакции сопровождаются гетеролитическим распадом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора. Гетеролитические реакции по характеру реагента подразделяют на два типа:
· нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов реагента (нуклеофила);
· электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата, реагент – электрофил.
Такое деление реакций справедливо для элементарных стадий, т. к. во многих реакциях происходит одновременно разрыв и образование новых связей за счет перемещения электронов с образованием переходного комплекса.
По направлению и конечному результату (по суммарному изменению, происходящему в исходных молекулах) различают следующие реакции:
· реакции, протекающие с сохранением углеродного скелета;
· реакции, протекающие без сохранения углеродного скелета.
Реакции, протекающие с сохранением углеродного скелета:
· реакции присоединения – А (от англ. addition);
· реакции отщепления – E (от англ. elimination);
· реакции замещения – S (от англ. substitution);
· реакции перегруппировки (изомеризации);
· конденсации;
· поликонденсации;
· полимеризации;
· перциклизации.
Реакции, протекающие без сохранения углеродного скелета:
· удлинения цепи;
· укорачивания цепи;
· циклизации;
· раскрытия цикла;
· сжатия и расширения цикла.
По предпочтительному образованию одного из нескольких возможных изомеров:
· региоселективные и региоспецифичные;
· стереоселективные и стереоспецифичные;
· хемоселективные;
· кислотно-основные взаимодействия;
· согласованные реакции.
Региоселективные реакции – реакции, предпочтительно протекающие по одному из нескольких реакционных центров с образованием смеси структурных изомеров с преобладанием одного из них.
Региоспецифичные реакции – реакции, протекающие с образованием только одного из изомеров.
Стереоселективные реакции – реакции, протекающие с предпочтительным образованием одного из стереоизомеров.
Стереоспецифические реакции – реакции, в результате которых из данного стереоизомерного соединения получается только один стереоизомер.
Хемоселективные реакции – реакции, предпочтительно протекающие по одной из родственных групп.
Согласованные (синхронные) реакции – реакции, в которых разрыв старых связей и образование новых связей происходит одновременно без участия радикалов или ионных частиц.
Молекулярность органической реакции определяют по числу молекул, в которых происходит реальное изменение ковалентных связей на лимитирующей стадии реакции. Различают следующие виды реакций:
мономолекулярные – на лимитирующей стадии участвует одна молекула; бимолекулярные – две молекулы и т. д.
По агрегатному состоянию реагирующих веществ реакции подразделяют на гомогенные, т. е. протекающие в одной фазе и гетерогенные, идущие на границе раздела фаз.
Часто органические реакции классифицируют по принадлежности реагентов или продуктов реакции к различным классам соединений. Например – гидрирование, гидратация, галогенирование, алкоголиз, эфиролиз и т. д.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 785; Нарушение авторских прав?; Мы поможем в написании вашей работы!