
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, определяющие реакционную способность органических соединений
|
|
|
|
I. Статические факторы (нереагирующее состояние):
· электронные факторы, обусловленные распределением электронной плотности в молекуле, предопределяющие появление реакционных центров в субстрате и направление атаки на него соответствующего реагента;
· стерический фактор, обусловливающий пространственные затруднения для атаки реагентом реакционного центра субстрата, окруженного объемными заместителями.
II. Динамические факторы (проявляются в процессе многостадийной реакции), определяющие предпочтительное протекание реакции в направлении образования наиболее стабильного интермедиата.
Кинетически контролируемая реакция – реакция, завершающаяся получением изомера, скорость образования которого наибольшая (в мягких условиях).
Термодинамически контролируемая реакция – преимущественное образование изомера с большей термодинамической устойчивостью (в более жестких условиях).
Характеристика компонентов реакций. Тип расщепления ковалентной связи. Каждая органическая реакция приводит к образованию соответствующих продуктов, т. е. характеризуется определенным направлением. С другой стороны, образование продуктов реакции протекает обычно через специфические для данной реакции промежуточные стадии. Из участвующих в реакции нескольких веществ одно часто рассматривается в качестве субстрата – объекта превращения, а другое реагента – атакующее вещество. При выборе реагента и субстрата руководствуются следующими правилами:
· в качестве субстрата выбирается соединение, один из атомов углерода которого является реакционным центром, тогда реагентом является вещество, атакующее С – атом субстрата;
· если в результате реакции образуется новая С–С связь, то в качестве реагента рассматривается соединение, у которого в реакции участвует более полярная связь.
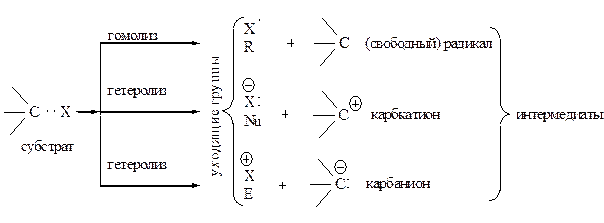
Субстрат – органическое соединение более сложного строения, чем реагент, поставляющее для образования новой связи атом углерода.
Уходящая группа – замещаемая часть субстрата (Х).
Электрофуг – уходящая группа без пары электронов.
Нуклеофуг – уходящая группа с парой электронов.
Реакционный центр – атом или группа атомов, непосредственно участвующих в данной химической реакции.
Классификация реагентов проводится по наличию сродства к ядру (нуклеофилы), к электронам (электрофилы) или к атомам (радикалы). Первые два типа реагентов имеют четное число электронов, радикалы несут неспаренный электрон.
Свободные радикалы –атомы или частицы с неспаренным электроном.
Образуются при гомолитическом расщеплении ковалентной связи в результате:
· фотолиза;
· термолиза;
· окислительно-восстановительной реакции;
· под действием ультразвука.
Электрофильный реагент (электрофильная частица, электрофил – Еδ+ или ЕÅ) – положительно заряженный ион, электронейтральная молекула с электронодефицитным атомом или сильнополяризованная молекула, образующаяся в реакции комплексообразования с кислотами Льюиса. Электрофил – акцептор электронной пары. Чем выше электронодефи-цитность электрофила, тем выше его электрофильность.
Нуклеофильный реагент (нуклеофильная частица, нуклеофил – Nu) – отрицательно заряженный ион или электронейтральная молекула с атомом, имеющим свободную электронную пару, идущую на образование новой ковалентной связи. Нуклеофил – донор электронной пары. Нуклеофильность возрастает с уменьшением электроотрицательности атома (сравниваются элементы одного периода) и увеличением поляризуемости (сравниваются элементы одной группы). ЭД – заместители увеличивают, ЭА – заместители ослабляют нуклеофильные свойства. Анионы более нуклеофильны, чем нейтральные молекулы.
Таблица 11 – Примеры реагентов
| Свободные радикалы | Электрофилы | Нуклеофилы | |||
| строение | название | строение | название | строение | название |

| галоген | Н+ | протон | 
| гидрид-ион |
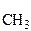
| метил- | Н3О+ | катион гидроксония | 
| вода |
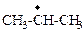
| изопропил- | N+O2 | катион нитрония | 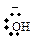
| гидроксид-ион |
| Продолжение таблицы 11 | |||||

| бензоил- | N+O | катион нитрозония | 
| цианид-ион |

| бензоат- | [Ar-NºN]+ | катион диазония | 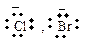
| хлорид, бромид-ион |
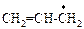
| аллил- | 
| карбонил | 
| метоксид-ион |

| бензил- | SO3 | триоксид серы | 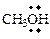
| метанол |
| – | – | R-C+=O | катион ацилия | 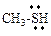
| метантиол |
| – | – | 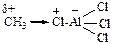
| – | 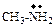
| метанамин |
| – | – | – | – | 
| диметило-вый эфир |
Амбидентный ион – термин, используемый для описания активных частиц, обладающих двумя различными взаимодействующими центрами, каждый из которых, в зависимости от условий, может участвовать в образовании различных химических связей.
Интермедиат – частица со временем жизни больше одного молекулярного колебания (10-13 сек). Интермедиат образуется из реагентов и ему соответствует локальный минимум потенциальной энергии. Превращения интермедиата приводят к продуктам реакции.
Карбанион – отрицательно заряженная частица (анион) имеющая четное число электронов, в которой отрицательный заряд (НЭП) полностью либо частично принадлежит одному или нескольким атомам углерода.
Карбен – термин, обозначающий частицы содержащие нейтральный атом углерода, имеющий два заместителя или два несвязывающих электрона, которые могут быть в синглетном или триплетном состоянии.
Карбин – термин, используемый для обозначения частицы Н · C: и ее производных (R · C:), в которых одновалентный атом углерода обладает тремя несвязанными электронами.
Карбкатион (карбениевый или карбониевый ион) – положительно заряженная частица, имеющая четное число электронов, в котором положительный заряд расположен на одном или нескольких атомах углерода. Часто этот термин применяют для карбкатионов, в которых атом углерода с избытком положительного заряда, обладает вакантной р -орбиталью.
Таблица 12 – Электронное строение интермедиатов.
| Название интер-та | Структ. | Гибридизация | Конфигурация | |
| Свободный радикал | 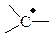
| sp2 | плоская | 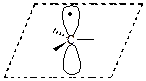
|
| Карбкатион | 
| sp2 | плоская | 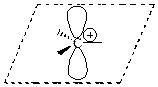
|
| Карбанион | 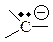
| sp2 (в сопряженной системе) | плоская | 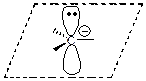
|
| sp3 (связан с sp3-гибридизованным атомом) | тетраэдр. | 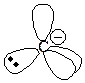
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1219; Нарушение авторских прав?; Мы поможем в написании вашей работы!