
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
Предельные углеводороды являются наименее реакционно-способными органическими соединениями. Их часто называют парафинами (от лат. parum affinis – малое сродство).
1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
1.1 Галогенирование. Алканы вступают в реакцию со всеми галогенами, скорость реакции галогенирования снижается в ряду:
F > Cl > Br > I
Механизм реакции галогенирования (SR):
а) инициирование цепи реакции:
Hal2 2Hal•
2Hal•
б) рост цепи:
R–H + Hal• R• + HHal
R• + HHal
R• + Hal2  R–Hal + Hal•
R–Hal + Hal•
в) обрыв цепи:
2Hal•  Hal2
Hal2
R• + R•  R–R
R–R
R• + Hal• R–Hal
R–Hal
Наличие в углеводородной цепи различных углеродных атомов может приводить к образованию различных изомеров. При низких температурах реакция проходит избирательно, которая зависит от двух причин:
· легкость отщепления водорода от углеродного атома, которая изменяется в ряду третичный > вторичный > первичный;
· различная устойчивость алкильных радикалов.
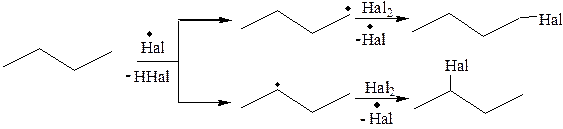
Образующиеся радикалы обладают различной устойчивостью, которая уменьшается в ряду:
третичный > вторичный > первичный > СH3•
Стабильность радикалов определяется делокализацией неспаренных электронов, которая осуществляется за счет сверхсопряжения с С–Н связями. Чем больше таких связей, тем эффективнее делокализация и, следовательно, устойчивее радикал.

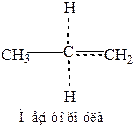
Делокализация неспаренного электрона у вторичного атома осуществляется между шестью атомами водорода и одним углеродным атомом.

Устойчивость радикалов определяет направление реакции и реакционную способность во многих реакциях, в которых образуются свободные радикалы.
При высоких температурах соотношение продуктов реакции определяется активностью радикальных частиц, которые эффективно преодолевают энергетический барьер разрыва при сближении с любым атомом водорода. Поэтому, на первый план выступает общая частота столкновений и ориентация молекул.
1.1.1 Фтор:
СН4 + 4F2  СF4 + 4HF
СF4 + 4HF
1.1.2 Хлор (катализатор – сера, йод, хлориды олова, меди, сурьмы, алюминия):
СН4 + Cl2  СH3Cl + HCl
СH3Cl + HCl
1.1.3 Бром:
СН4 + Br2  СH3Br + HBr
СH3Br + HBr
1.1.4Фотохимическоеиодирование не удается осуществить вследствие низкой реакционной способности радикала иода.
1.1.5Процесс хлорирования в присутствии катализаторов, например, хлоридов некоторых металлов, может иметь ионный цепной характер:
Сl: Cl + AlCl3  AlCl4– + Cl+
AlCl4– + Cl+
Cl+ +H–СН3  HCl + СН3+
HCl + СН3+
СН3+ + Сl: Cl  Сl: СН3 + Cl+
Сl: СН3 + Cl+
1.2 Сульфохлорирование и сульфоокисление:
R–H + H2SO4 (дымящая)  R – SO3H + H2O
R – SO3H + H2O
R–H + SO2 + Cl2  R–SO2Cl + HCl
R–SO2Cl + HCl
R – H + SO2 + O2  R – SO3H
R – SO3H
Соли сульфокислот имеют широкое практическое значение – это анионные ПАВ, моющие средства, эмульгаторы, флотореагенты, присадки к техническим маслам, ингибиторы коррозии.
1.3 Нитрование. В зависимости от условий протекания различают:
· жидкофазное нитрование (7–20 % азотная кислота, нормальное давление и температура 110–140 оС), реакция Коновалова (1888 г.):
R–H + HNO3  R–NO2 + H2O
R–NO2 + H2O
· парофазное нитрование (оксидами азота при давлении 2–4,5 МПа, температура 150–220 оС в присутствии кислорода), реакция Титова:
R–CH2–R + HNO3  R–NO2 + R–CH2–NO2 + H2O
R–NO2 + R–CH2–NO2 + H2O
Азотная кислота действует как окислитель, а радикал нитрозония амбидентен, поэтому могут образовываться эфиры азотистой кислоты наряду с нитросоединениями, а так же спирты, карбонильные соединения и карбоновые кислоты.
2. Окисление. В присутствии большого избытка кислорода (воздуха) или окислителей (K2CrO4, K2Cr2O7) при высоких температурах алканы сгорают до воды и углекислого газа:
R–H + O2  СO2 + H2O
СO2 + H2O
При ограниченном доступе кислорода возможно образование продуктов неполного сгорания предельных углеводородов:
R–H + O2  СO + H2O
СO + H2O
R–H + O2  С + H2O
С + H2O
В определенных условиях возможно проведение контролируемого окисления при котором происходит расщепление связей С–С при неполном окислении атомов углерода:
· Парофазное окисление используется для получения высших жирных карбоновых кислот. Катализатор – ацетат марганца, температура 150 оС:

· Жидкофазное окисление (А.Н. Башкиров, 1959 г.) в присутствии катализатора, например соединений марганца и температуре 200 оС:
СnН2n+2.  СnН2n+1ОН
СnН2n+1ОН
· Твердофазное окисление (окислительная деструкция) характерна для старения олефинов под действием атмосферного кислорода, инициированная облучением, перекисью, нагреванием:
R–R  2R•
2R•
R• + O=O  R–O–O•
R–O–O•
R–O–O• + R–H  R–O–O–H + R•
R–O–O–H + R•
R–O–O–H  R–O• + •O–H
R–O• + •O–H
R–O• + R–H  R–OH + R•
R–OH + R•
R–O• + 2R–H  H2O + 3R•
H2O + 3R•
3. Термические превращения алканов. Различают следующие процессы:
3.1 Пиролиз (от гр. pyr – огонь, lysis – распад, разложение). Включает разложение и деструктивные превращения высокомолекулярных алканов при температурах выше 600 оС:
2СН4  СН2= СН2 + 2Н2
СН2= СН2 + 2Н2
2СН4  СН≡СН + 3Н2
СН≡СН + 3Н2
СН4  С + 2Н2
С + 2Н2
3.2 Крекинг (от англ. cracking – расщепление) в отличие от пиролиза протекает при более низких температурах до 600 оС (В.Г. Шухов и С. Гаврилов, 1890 г.) Существует несколько видов крекинга, наиболее известны:
· термический крекинг;
· каталитический крекинг.
Термический крекинг протекает в основном по цепному радикальному механизму с разрывом С–С и С–Н связей. Так как концентрация радикалов небольшая, основными являются процессы диспропорционирования и β -распада, при температуре 300–350 оС, но наиболее оптимальными являются температуры 450–600 оС.
Каталитический крекинг обеспечивает глубокую переработку нефти при температурах 450–520 оС, катализатор – алюмосиликаты (Э. Гудри, 1936 г.). Основные процессы изомеризации, деалкилирования, циклизации и др.
3.3 Риформинг (Н.Д. Зелинский, 1902 г.). Катализатор – платина и палладий, алюмоплатиновые, би- и полиметаллические. Основные процессы дегидрогенизация с образованием ароматических соединений.
Широкое распространение получили два варианта риформинга гидроформинг (гидрокрекинг) и платформинг. Основной целью риформинга является получение высококачественных бензина и керосина.
Гидроформинг (350–450 °С, 3–14 МПа, катализатор – оксиды и сульфиды Мо, Ni на алюмосиликатах). Применение водорода обеспечивает гидрирование на катализаторе высокомолекулярных и сернистых соединений с последующим их распадом, гидрирование алкенов.
Платформинг – каталитический крекинг, осуществляемый с помощьюпалладия, платины (менее 1%) на оксиде алюминия и алюмосиликатах. Основные процессы изомеризация, дегидроциклизация, ароматизация.
Термические некаталитические и каталитические превращения алканов осуществляются по следующей схеме:
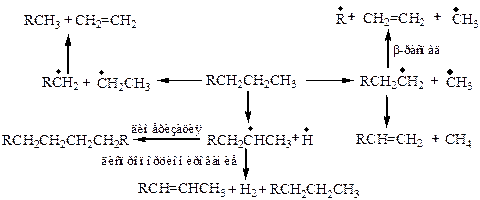
Применение алканов. Алканы являются не только простым и относительно дешевым топливом, но и исходным сырьем для крупнотоннажного производства. Промышленное использование алканов можно иллюстрировать на примере превращений метана:
4СН4 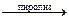 СН2= СН2 + СН≡СН + 5Н2
СН2= СН2 + СН≡СН + 5Н2
СН4 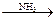 HCN
HCN 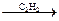 СН2=СН–CN
СН2=СН–CN  синт. волокно нитрон, натур. каучук
синт. волокно нитрон, натур. каучук
СН4  CН3NО2
CН3NО2  NО2С(CН2ОН)3
NО2С(CН2ОН)3  взрывчатые вещества
взрывчатые вещества
СН4 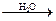 СО + H2
СО + H2  CН3ОН
CН3ОН 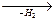 CН2О
CН2О  пластмассы
пластмассы
СН4 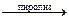 С + H2 (сажа, резиновая промышленность)
С + H2 (сажа, резиновая промышленность)  NH3
NH3
СН4  СH2Cl2
СH2Cl2 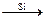 (СH3)2SiCl2
(СH3)2SiCl2  силиконы
силиконы
СН4  СHCl3 (хлороформ)
СHCl3 (хлороформ)  СCl4
СCl4 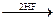 ССl2F2 (фреон)
ССl2F2 (фреон)
Высшие жирные и твердые парафины используются как топливо (дизельное), смазочный материал, в виде твердого парафина, озокерита, а их производные, в виде солей карбоновых кислот, как моющие средства.
Экологическое послесловие. Загрязнение алканами атмосферы, почвы, водоемов, подземных вод в значительных масштабах происходит при добыче нефти, газа, транспортировке жидких и газообразных углеводородов, переработке, производстве, применении углеводородов.
Экология почвы. Наиболее крупными источниками загрязнения почвы углеводородами являются нефтеразведка, добыча, транспортировка нефти и нефтепродуктов, при их применении и хранении. Особую опасность представляют загрязнение и нарушение верхнего слоя почв северных территорий, что обусловлено очень медленной скоростью их естественного восстановления.
Экология водоемов, подземных вод. Основные источники загрязнения – добыча нефти, транспортировка нефти и нефтепродуктов, промышленные стоки, технологии очистки промышленных стоков, связанные с закачкой их в подземные горизонты.
Экология атмосферы. Основными источниками загрязнения атмосферы являются: выделение углекислого газа в результате сжигания углеводородов, поступление газообразных углеводородов в атмосферу при газо-, нефтедобыче, разрывах газопроводов, промышленных газообразных выбросах, испарениях при переработке, транспортировке, хранении, заполнении различных емкостей нефтью и нефтепродуктами, сушке лакокрасочных покрытий.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!