
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 9. Растворы и дисперсные системы. Растворы электролитов
|
|
|
|
На предыдущей лекции мы рассмотрели коллигативные совйства растворов. Однако, ещё в середине XIX оказалось, что существует целый ряд веществ (например, соли, основания, кислоты), которые не подчиняются законам Вант-Гоффа и Рауля. Значения осмотического давления, понижения температуры замерзания и повышение температуры кипения, определённые экспериментально для этих растворов, получались всегда более высокими, чем это следовало из моляльных концентраций. Так, например, при растворении 1 моля NaCl в 1000 г воды понижение температуры замерзания составило не 1,86, а 3,36 градуса, то есть примерно в 2 раза больше ожидаемого.
Если, основываясь на наших сегодняшних знаниях, рассматривать ионы как самостоятельные частицы, то тогда можно объяснить наблюдаемые отклонения от законов Вант-Гогффа и Рауля. Например, при растворении NaCl в H2O частиц в растворе образуется в два раза больше, поэтому, они вызывают вдвое более сильные эффекты, чем неэлектролиты. Чтобы учесть наблюдаемую зависимость в формулы для разбавленных растворов неэлектролитов был введён поправочный коэффициент i – так называемый изотонический коэффициент или коэффициент Вант-Гоффа.. Тогда для растворов электролитов законы Вант-Гоффа и Рауля получают следующие выражения:
для осмотического давления
p = icRT
для давления пара над раствором
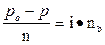
для температур кипения и замерзания
Δtкип. = iEcm; Δtзам. = iKcm
Изотонический коэффициент показывает, во сколько раз наблюдаемое на опыте осмотическое давление р’ понижение давления пара Δр’ повышение температуры кипения Δtкип. , понижение температуры замерзания Δtзам. данного электролита больше вычисленного на основе законов Вант-Гоффа и Рауля для неэлектролитов.
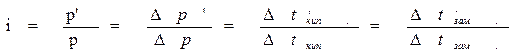
Изотонический коэффициент определяется экспериментально по понижению давления пара или по понижению температуры кипения или по повышению температуры замерзания. Получаемые данные подтверждают, что величина i различна для различных электролитов и растёт с разведением, приближаясь к целым числам: 2 – для электролитов, распадающихся на два иона (например, для 0,2н растворов KCl i = 1,81, KNO3 I = 1,78), 3 – для электролитов, при диссоциации которых образуются три иона (MgCl2, Ca(NO3)2 и т. д.)
Наблюдаемые результаты приводили к выводу о возможной диссоциации молекул электролита на более мелкие частицы.
Природу этого явления удалось объяснить лишь позднее.
Полярные молекулы, или кристаллы ионного типа, образуют растворы, проводящие электрический ток. Электрическая проводимость в растворах электролитов создаётся направленным перемещением ионов – электрически заряженных частиц, имеющих положительный или отрицательный заряд. В целом электролит нейтрален, так как сумма его положительных и отрицательных зарядов равна нулю.
Электролитом называется система, содержащая положительно и отрицательно заряженные ионы, существующие независимо от внешних электрических или магнитных полей.
Образование электролитов может происходить различными путями:
1. диссоциация полярных молекул под действием полярных молекул растворителя;
2. растворение ионных кристаллов с образованием гидратированных ионов;
3. плавление ионных кристаллов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!