
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитической диссоциации
|
|
|
|
В 1887г. шведский ученый Сванте Август Аррениус (1859—1927 гг.) предложил теорию электролитической диссоциации, сущность которой сводится к следующему:
Вещества, растворы которых являются электролитами, при растворении распадаются на частицы (ионы), несущие положительные и отрицательные заряды.
Растворы являются проводниками электрического тока тогда, когда они содержат ионы. Чем больше растворённых частиц распадается на ионы, тем лучше они проводят электрический ток, т.е. тем лучше их электрическая проводимость. По мере распада электролитов на ионы растет общее число частиц, находящихся в растворе, так как при этом из одной частицы получается две и более. Следовательно, законы Рауля и Вант-Гоффа верны для растворов электролитов, если учитывать как недиссоциированные частицы, так и образующиеся при их распаде ионы. Ионы, заряженные положительно, получили название катионов, а отрицательно заряженные — анионов. Катионами являются положительные ионы металлов, ион водорода, а анионами — водные и кислотные остатки. Значение заряда иона совпадает с валентностью атома или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов. Поэтому в целом раствор электронейтрален.
Процесс электролитической диссоциации изображается так:
Al2(SO4)3 =2Al3+ + 3SO42-
H2SO4 = 2H+ + SO42-
Ca(OH)2 = Ca2+ + 2OH-
Теория электролитической диссоциации объяснила многие явления, связанные со свойствами растворов электролитов, но не ответила на вопросы, почему одни вещества являются электролитами, а другие — нет, а также, какую роль в образовании ионов играет растворитель. Ответы могли быть даны только после установления природы химической связи. Опыт показывает, что распад молекул солей, кислот и оснований на ионы происходит только в растворителях, молекулы которых полярны, а свойствами электролита обладают вещества с сильно полярной и ионной связью.
Электролитическая диссоциация соединений зависит как от характера химических связей в них, так и от характера растворителя.
Рассмотрим на конкретном примере механизм диссоциации. Представим себе, что ионный кристалл, например, кристалл поваренной соли, помещён в воду. Каждый ион, находящийся на поверхности кристалла, образует вокруг себя электростатическое поле. Вблизи Na+ создается поле положительного знака, а вблизи Cl- — отрицательное. Влияние этих полей простирается на некоторое расстояние от кристалла. В растворе кристалл со всех сторон окружают беспорядочно движущиеся полярные молекулы воды. Попадая в поле действия электрически заряженных ионов, они изменяют своё движение, и в непосредственной близости от кристалла они ориентируются таким образом, что к отрицательно заряженному иону хлора диполи воды оказываются направленными положительно заряженным концом, а к положительно заряженному иону натрия — отрицательным концом. Такое явление, происходящее в электростатическом поле, называется ориентацией полярных молекул. Между ионами и диполями воды действуют кулоновские силы притяжения. В результате ион-дипольного взаимодействия выделяется энергия, которая способствует разрыву ионных связей в кристалле и переведению иона из кристалла в раствор (см. рис.).
Отделенные друг от друга ионы тотчас же после разрыва связи между ними вплотную окружаются полярными молекулами воды и становятся полностью гидратированными ионами. Явление взаимодействия ионов с молекулами воды, в результате чего происходит образование гидратной оболочки, называется гидратацией ионов. Теплота, выделяющаяся при гидратации ионов, называется теплотой гидратации и выражается в джоулях на моль (Дж/моль). Так, при гидратации 1 моля ионов натрия выделяется 422 кДж, а при гидратации 1 моля хлоридных ионов - 351 кДж. Теплоты гидратации ионов превосходят тепловые эффекты многих химических реакций.
Гидратированные ионы, имеющие противоположные заряды, могут взаимодействовать друг с другое. Но так как ионы движутся в растворе вместе с образовавшимися вокруг них гидратными оболочками, то сила их взаимодействия значительно уменьшена и они способны к самостоятельному существованию. Сила взаимодействия гидратированных ионов зависит от свойств растворителя, одним из которых является диэлектрическая проницаемость.
Диэлектрическая проницаемость показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в вакууме.
Электролитическая диссоциация легче происходит в растворителях с более высокой диэлектрической проницаемостью, так как в них ослабевает взаимодействие между ионами. Необходимо отметить, что высокая диэлектрическая проницаемость растворителя облегчает диссоциацию, но не вызывает ее. Активную роль в процессе диссоциации выполняют полярные молекулы растворителя.
С учётом гидратации ионов уравнения электролитической диссоциации электролитов следовало бы записывать, например, так:.
NaCl + (n+m)H2O = Na+·nН2О + Сl-·mH2О
Ввиду того, что состав гидратированных ионов не всегда постоянен и связь не очень прочна, эти уравнения обычно записывают упрощённо:
NaCl=Na++Cl-
Рассмотрим растворение полярных соединений на примере НСl. При растворении хлористого водорода в воде происходит ориентация диполей воды вокруг растворенных молекул, вызывающая ещё большую поляризацию молекул хлороводорода (). Полярная связь между атомами водорода и хлора переходит в ионную. При этом общая электронная пара целиком сдвигается к атому хлора, и в. результате происходит гетеролитический разрыв молекулы. Атом хлора превращается в гидратированный хлорид-ион, а протон с молекулой воды образует сложную положительно заряженную частицу Н3O+, называемую ионом гидроксония:
НСl + хH2O = H3О+ + Сl-·(х - 1) Н2О
Ион гидроксония H3О+ и гидратированный хлорид-ион в уравнениях электролитической диссоциации условно указывают как ионы водорода и хлора, то уравнение можно записать так:
НСl = H+ + Сl-
При этом нужно помнить, что среднеионный радиус индивидуального протона, иона Н+ составляет порядка 10-15 нм, а все частицы, молекулы или ионы, существующие в растворе имеют размеры порядка 10-9 нм. Из сказанного очевидно, что по соотношению заряд - радиус индивидуальный протон является чрезвычайно реакционноспособной частицей и не может существовать в растворе. Н3О+ - продукт донорно-акцепторного взаимодействия иона водорода и молекулы воды (либо гетеролитического распада т.н. мостиковых структур воды. В настоящее время полагают, что в воде существуют также ионы Н5О2+, Н7О3+ и т.д.
Сделаем выоды: а) электролитами могут: быть только соединения с ионной или ковалентной полярной связью, т. е. соли, основания и кислоты и б) электролиты способны диссоциировать на ионы только в полярных растворителях.
.
Вода. Её свойства. Расчёт рН в растворах сильных кислот и оснований
Вода является чрезвычайно малодиссоциированным веществом. В начале ХХ века на основании измерения электрической проводимости высокочистой воды было определено, что 1 килограмм (или 1 литр) воды содержат 10-7 моль ионов водорода и, соответственно, столько же ионов гидроксила. Диссоциация воды описывается следующим уравнением:
Н2О Û Н+ + ОН-.
Согласно закону действующих масс, константа равновесия этой реакции

(а – активность, эффективная, действующая концентрация данног компонента, детально обсудим далее)
Однако, диссоциация воды происходит в столь незначительной степени, что активность воды в воде численно равна её концентрации и составляет 55,56 моль/л. Перенесём все постоянные в левую часть уравнения и получим выражение:
 .
.
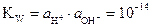 . (1)
. (1)
или приближённо Кw´= [H+]●[OH-]
Величина Кw называется ионным произведением (ИП) воды. ИП описывает равновесие диссоциации воды, и это равновесие «работает» во всех водных растворах. Из рассмотрения уравнения (1) вытекает, что невозможно независимо изменять концентрацию Н+ - ионов в растворе, предполагая, что концентрация ОН- -ионов останется неизменной. Нетрудно рассчитать концентрацию ионов водорода и гидроксила в 0,001 н HCl. соляная кислота – сильная кислота, она полностью диссоциирована на ионы, соответственно, [H+]=CN(HCl)=10-3 моль/л. В соответствии с уравнением (1), в данном растворе [OH-]=10-11 моль/л. Рассуждая аналогично, приходим к выводу, что в 0,01 н растворе NaOH содержится [H+]= 10-2 моль/л, a [OH-]=10-12 моль/л. Итак, в кислом растворе количество ионов водорода больше 10-7 моль/л (или моль/кг) в нейтральных – равно, в щелочных – меньше указанной величины.
Для характеристики кислотно-основных свойств растворов по предложению датского физико-химика С. Сёрнсена используют водородный показатель, рН. Водородный показатель, рН равен величине десятичного логарифма активности ионов водорода, взятого с противоположным знаком. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма активности ионов гидроксила.
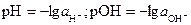 (2)
(2)
Логарифмированием уравнения (1) получаем:
рН + рОН = 14. (3)
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН < 7, в щелочной среде рН > 7.
В неидеальных растворах (жидких и твёрдых) наблюдается более сложный характер взаимодействия между различными компонентами раствора, и зависимости свойств реальных растворов от концентрации лишь приближённо соответствуют наблюдаемым в случае идеальных растворов. Для учёта отклонения состояния реальных растворов от идеальных, Льюис предложил использовать в термодинамических соотношениях вместо концентрации активность. По смыслу активность является некоей действующей концентрацией вещества в реальном растворе. Активность феноменологически учитывает суммарный вклад всех дополнительных межчастичных взаимодействий (не уточняя детально характеристики и долю каждого из них), отличающих реальный раствор от идеального. Активность связана с концентрацией через коэффициент активности: a i = [ C i]● γi.
Активность иона равна произведению его моляльности на моляльный коэффициент активности gi:
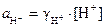 ,
,
где [Н+] - моляльная концентрация ионов Н+ в моль/кг. Отсюда после логарифмирования получаем формулы для расчета рН в кислых растворах:
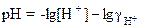 ; (4)
; (4)
и в щелочных растворах:
 ; pH = 14 - pOH. (5)
; pH = 14 - pOH. (5)

 Для сильных кислот и щелочей, полностью диссоциированных на ионы,
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
[Н+] = z×Cк и [ОН-] = z×Cщ,
где Ск и Сщ - моляльные концентрации кислоты и, соответственно, щелочи, z - основность кислоты или кислотность основания.
Среднеионные моляльные коэффициенты активности ионов в бинарных растворах находят в справочниках или рассчитывают. При ионной силе раствора менее 0,1 моль/кг используют уравнение второго приближения теории Дебая и Хюккеля:
 . (6)
. (6)
При ионной силе раствора от 0,1 до 1 моль/кг коэффициент активности рассчитывают по полуэмпирическому уравнению Дэвис:
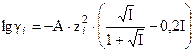 , (7)
, (7)
где z i - заряд иона, A - теоретический коэффициент, равный для водных растворов 0,51 при 298 К, I- ионная сила раствора, равная полусумме произведений концентраций всех ионов в растворе на квадраты их зарядов:
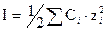 (8)
(8)
В разбавленных растворах, при С < 10-4 моль/кг, ионная сила близка к нулю, а коэффициент активности к единице.
Разбавление раствора рассчитывают путем деления концентрации ионов в формулах (4) и (5) на величину разведения n. После логарифмирования получаем:
в кислой среде: рН2 = рН1 + lgn;
в щелочной среде: рН2 = рН1 - lgn, (9)
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления).
Однако следует учитывать, что при любом разбавлении кислого раствора рН2 £ 7, а при разбавлении щелочного раствора рН2 ³ 7. Поэтому в среде, близкой к нейтральной, в интервале значений рН1 = 7 ± lgn, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+иОН -. Рассмотрим разбавление щелочного раствора М(ОН) z в n раз. Согласно условию электронейтральности, суммарные эквивалентные концентрации катионов и анионов равны между собой:
[Н+] + z[Mz+] = [OH-].
Учитывая формулу (2), сильное разбавление (gi = 1) и [Mz+] = Сщ, получаем:
 .
.
Для кислого раствора аналогично можно вывести формулу:
 .
.
После разбавления Ск¢ = Ск/nили Сщ¢ = Сщ/n, а концентрации ионов Н+ или ОН - находят решением квадратных уравнений:
в кислом растворе 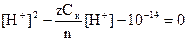 ;
;
в щелочном растворе 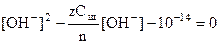
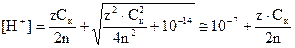 (10)
(10)
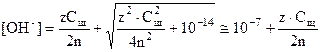 (11)
(11)
Смешивание растворов сильных кислот и оснований рассчитывают исходя из двух возможных вариантов.
1. рН1<7и рН2<7 или рН2>7ирН2>7, то есть смешивают два кислых или два щелочных раствора. Для расчета конечной концентрации суммируют числа молей одноименных ионов и объемы растворов. Учитывая, что число молей равно произведению молярной концентрации на объем, получаем для кислых растворов
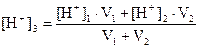 (12)
(12)
Для щелочных растворов [Н+]в (12) заменяют на [ОН-].
2. рН1<7, а рН2>7, то есть смешивают кислый и щелочной растворы. В этом случае конечную концентрацию раствора рассчитывают по веществу, взятому в избытке. Предположим, что в избытке взята кислота. Тогда получаем:
 (13)
(13)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1565; Нарушение авторских прав?; Мы поможем в написании вашей работы!