
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы слабых кислот и оснований
|
|
|
|
Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молекул к общему числу молекул электролита в растворе называют степенью диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению:
НА Û Н+ + А-, где А - кислотный остаток, (14)
степень диссоциации a равна:
a = [Н+] / С,(15)
где С - концентрация кислоты в моль/л или в моль/кг.
Многоосновные кислоты диссоциируют ступенчато, например:
Н3РО4 Û Н2РО4- + Н + (1-ая ступень);
Н2РО4- Û НРО42- + Н+ (2-ая ступень);
НРО42- Û РО43- + Н+ (3-я ступень).
Обычно константа диссоциации по второй ступени приближенно в 104-105 раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнение (14) приближенно описывает диссоциацию и многоосновных кислот.
Диссоциация слабых электролитов - равновесный процесс. Для его количественного описания используют константу равновесия, называемую константой диссоциации:
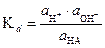 (16)
(16)
Константу диссоциации находят в справочнике или рассчитывают по термодинамическим данным:
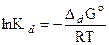 , где
, где 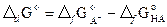 (17)
(17)
Энергии Гиббса образования A- и HA в водном растворе при 298 К находят в справочнике. Константы диссоциации при других температурах рассчитывают по уравнению изобары реакции в интегральной форме:
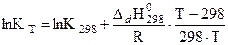 (18)
(18)
Значение константы диссоциации используют для расчета рН раствора.
В рамках теории Дебая и Хюккеля по уравнению (6) получаем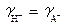 и
и 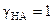 . Согласно уравнению (14) [Н+] = [А-]. Следовательно, a H + = a A -. Равновесная концентрация недиссоциированной кислоты равна разности между общей концентрацией и концентрацией образовавшихся ионов. С учетом формулы (15) получаем:
. Согласно уравнению (14) [Н+] = [А-]. Следовательно, a H + = a A -. Равновесная концентрация недиссоциированной кислоты равна разности между общей концентрацией и концентрацией образовавшихся ионов. С учетом формулы (15) получаем:
[НА] = С - [Н+] = С - aС = С(1 - a).
Так как в растворах слабых электролитов при умеренных разбавлениях a<< 1, то [НА] @ С. Преобразуем формулу (16):

отсюда 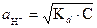 (19)
(19)
После логарифмирования уравнения (19) получаем:
 (20)
(20)
Для растворов слабых оснований можно вывести аналогичные формулы:
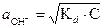 (21)
(21)
 , ( 22 )
, ( 22 )
где С - концентрация слабого основания, моль/кг.
По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита. Из формулы (19) следует:
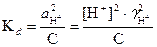 (23)
(23)
Домножив в (23) числитель и знаменатель дроби на С, с учетом формулы (15) получаем: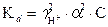 . Отсюда следует:
. Отсюда следует:
 (24)
(24)
Если в растворе нет посторонних солей, то ионная сила слабого электролита близка к нулю, и gН+@1 согласно уравнению (6). В отсутствие солевого фона (24) переходит в известную формулу Оствальда:
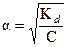 (25)
(25)
Словесная формулировка закона Оствальда: Степень электролитической диссоциации обратно пропорциональна квадратному корню из концентрации раствора.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 330; Нарушение авторских прав?; Мы поможем в написании вашей работы!