
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Идеальный газ. Основное уравнение МКТ
|
|
|
|
Контрольные вопросы.
Нарисуйте схемы алгоритмов:
o Решить линейное уравнение A · x + B = 0. Вещественные коэффициенты A и В вводятся с клавиатуры. Рассмотреть все возможные исходы, возникающие в случаях: A ¹ 0; A = 0, B ¹ 0; A = 0,
B = 0; переполнение типа. Реализовать схему так, чтобы выход из программы был единственным.
o Найти наибольший элемент побочной диагонали квадратной матрицы.
Идеальный газ – это совокупность хаотически движущихся материальных точек, все взаимодействия которых сводятся к упругому столкновению друг с другом и со стенками.
Таким образом, идеальный газ – это модель реального газа, в котором пренебрегают размерами молекул и взаимодействием между молекулами.
Внутренняя энергия U реального газа равна сумме кинетических энергий всех молекул Wk и сумме потенциальных энергий молекул:
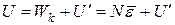 . (1.4.1)
. (1.4.1)
Если в формуле (1.4.1) принять
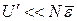 , (1.4.2)
, (1.4.2)
то реальный газ можно считать идеальным. Соотношение (1.4.2) выполняется, если газ сильно разрежен или находится при высокой температуре.
Как указывалось ранее (см. §3) для описания термодинамической системы используются параметры состояния. В качестве макроскопических параметров состояния конкретного идеального газа будем использовать одну из следующих четверок величин:
1) давление P, объём V, абсолютная температура T, число молекул N;
2) давление P, объём V, абсолютная температура T, масса газа m;
3) давление P, объём V, абсолютная температура T, количество вещества n.
Т.к.  , то эти четверки параметров состояния связаны между собой.
, то эти четверки параметров состояния связаны между собой.
Соотношение, определяющее связь между всеми четырьмя параметрами состояния термодинамической системы в равновесном состоянии, называется уравнением состояния.
Прежде, чем записать уравнение состояния идеального газа рассмотрим одно важное уравнение, которое называется основное уравнение МКТ.
Основное уравнение МКТ идеального газа устанавливает связь между макроскопическими параметрами данной массы газа – давлением P, объемом V и числом молекул N – и микроскопическими параметрами системы, такими как, средняя кинетическая энергия поступательного движения молекулы 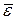 или квадрат средней квадратичной скорости
или квадрат средней квадратичной скорости 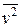 .
.
Вывод основного уравнения МКТ.
В модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
В результате каждого столкновения между молекулами и молекул со стенкой скорости молекул могут изменяться по модулю и по направлению; на интервалах между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Будем считать, что все молекулы имеют одинаковую массу mм. При столкновении молекулы со стенкой на нее действует сила нормальной реакции N (см. рис. 1.4.1). При упругом столкновении молекулы со стенкой модуль скорости молекулы не изменяется: 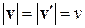 , и изменение импульса равно:
, и изменение импульса равно: 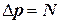 . По третьему закону Ньютона сила взаимодействия молекулы со стенкой
. По третьему закону Ньютона сила взаимодействия молекулы со стенкой 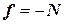 , Тогда, в проекции на ось x, имеем
, Тогда, в проекции на ось x, имеем
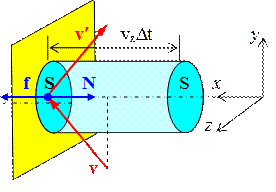
Рис. 1.4.1.
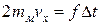 , Þ
, Þ 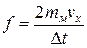 (1.4.3)
(1.4.3)
где D t – время взаимодействия молекулы со стенкой.
Выделим на стенке небольшую площадку площади S. За время D t с этой площадкой столкнутся молекулы, находящиеся в цилиндре объема 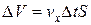 .
.
Пусть в единице объема сосуда содержатся n молекул; тогда число молекул в объеме цилиндра равно 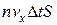 . Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время Δ t равно
. Но из этого числа лишь половина движется в сторону стенки, а другая половина движется в противоположном направлении и со стенкой не сталкивается. Следовательно, число ударов молекул о площадку S за время Δ t равно
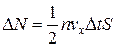 . (1.4.4)
. (1.4.4)
Сила давления молекул на стенку равна
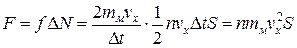 . (1.4.5)
. (1.4.5)
Разделим выражение для силы F на S, получим формулу для давления газа на стенку
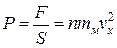 . (1.4.6)
. (1.4.6)
При выводе этого соотношения предполагалось, что все n молекул, содержащихся в единице объема газа, имеют одинаковые проекции скоростей на ось x. На самом деле это не так.
В результате многочисленных соударений молекул газа между собой и со стенками в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям. Распределение молекул газа по модулю скоростей называется распределением Максвелла (1860 г.).
Обозначим через DN(v) – число молекул, имеющих скорость в интервале (v, v+Dv). Функция 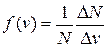 называется распределением молекул по скоростям или распределением Максвелла.
называется распределением молекул по скоростям или распределением Максвелла.
На рис. 1.4.2 представлены типичные кривые 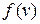 распределения молекул по скоростям.
распределения молекул по скоростям.
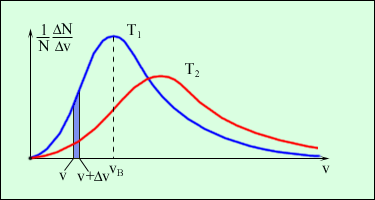
Рис. 1.4.2.
Относительное число молекул 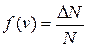 , скорости которых лежат в интервале от v до v+Dv, равно площади выделенного на рис. 1.4.2 столбика.
, скорости которых лежат в интервале от v до v+Dv, равно площади выделенного на рис. 1.4.2 столбика.
Характерными параметрами распределения Максвелла являются наиболее вероятная скорость vв, соответствующая максимуму кривой распределения, и среднеквадратичная скорость 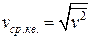 , где
, где 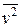 – среднее значение квадрата скорости. С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом vв и
– среднее значение квадрата скорости. С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом vв и 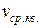 увеличиваются.
увеличиваются.
Прямое измерение скоростей молекул, вылетающих с поверхности твердого тела, было впервые выполнено в опыте Штерна (1920 г.).
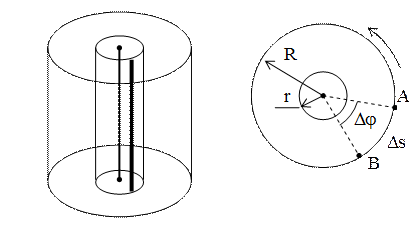
Рис. 1.4.3.
Схема опыта Штерна представлена на рис. 1.4.3. По оси двух коаксиальных цилиндров радиусов R и r натянута платиновая нить, покрытая серебром. При нагревании нити электрическим током с ее поверхности испаряются атомы серебра. Внутренний цилиндр радиуса r имеет узкую продольную щель, через которую проходит наружу узкий пучок атомов. Достигнув внешнего цилиндра, атомы серебра оседают в точке A, образуя слой в виде узкой вертикальной полоски. Если оба цилиндра привести во вращение с одинаковой угловой скоростью w, то полоска окажется уже в точке B, позади точки A. По длине дуги 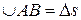 можно определить скорость атомов.
можно определить скорость атомов.
Полагая r << R, получим 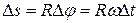 . Время пролета атомов равно
. Время пролета атомов равно 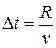 . Откуда можно найти скорость v атомов.
. Откуда можно найти скорость v атомов.
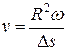 . (1.4.7)
. (1.4.7)
На самом деле в опыте была обнаружена не узкая ровная полоска, а размытая. Если сделать срез полоски серебра параллельно поверхности внешнего цилиндра, то под микроскопом можно увидеть след, изображенный на рис. 1.4.4. Профиль этого среза очень похож на кривую распределения Максвелла.
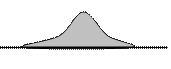
Рис. 1.4.4.
Уточним формулу (1.4.6) для давления газа на стенку сосуда. Для этого предположим, что все молекулы, содержащиеся в единице объема, разбиты на группы, содержащие n 1, n 2, n 3 и т. д. молекул с проекциями скоростей vx 1, vx 2, vx 3 и т. д. соответственно. При этом 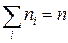 . Каждая группа молекул вносит свой вклад
. Каждая группа молекул вносит свой вклад 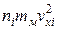 в давление газа. В результате соударений со стенкой молекул с различными значениями проекций vxi скоростей возникает суммарное давление
в давление газа. В результате соударений со стенкой молекул с различными значениями проекций vxi скоростей возникает суммарное давление
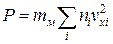 . (1.4.8)
. (1.4.8)
Входящая в это выражение сумма – это сумма квадратов проекций vxi всех n молекул в единичном объеме газа. Если эту сумму разделить на n, то мы получим среднее значение 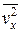 квадрата проекции
квадрата проекции 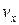 скорости молекул:
скорости молекул:
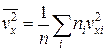 . (1.4.9)
. (1.4.9)
Тогда формула (1.4.8) для давления газа принимает вид:
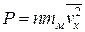 . (1.4.10)
. (1.4.10)
Так как все направления для векторов скоростей молекул равновероятны, среднее значение квадратов их проекций на координатные оси равны между собой:
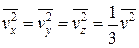 (1.4.11)
(1.4.11)
Последнее равенство вытекает из формулы: 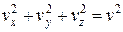 .
.
В результате получим основное уравнение МКТ.
 . (1.4.12)
. (1.4.12)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 595; Нарушение авторских прав?; Мы поможем в написании вашей работы!