
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изопроцессы
|
|
|
|
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние, например (P, V, T, и m). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. Квазистатические процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний (график процесса, например, в координатах p, V), каждая точка которой представляет равновесное состояние.
Переход системы из одного равновесного состояния в другое равновесное состояние называется термодинамическим процессом.
Особый интерес представляют изопроцессы. Изопроцессами называются квазистатические процессы, происходящие с идеальным газом постоянной массы, в котором еще один из трех параметров состояния (p, V или T) также не изменяется.
Из данного определения следует, что таких процессов три. Для их более подробного изучения запишем уравнение состояния (1.6.3) в виде:
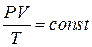 , (1.7.1)
, (1.7.1)
которое справедливо при m = const и называется уравнением Клапейрона.
1. Изотермический процесс (T = const).
Изотермическим процессом называется квазистатический процесс, протекающий при постоянной температуре T.
Из уравнения Клапейрона (1.7.1) следует, что для изотермического процесса произведение давления газа на его объем не изменяется (закон Бойля-Мариотта).
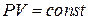 . (1.7.2)
. (1.7.2)
Закон Бойля-Мариотта – один из первых законов в истории науки, был открыт англичанином Р. Бойлем (1662 г.) и французом Э. Мариоттом (1676 г.).
Изотермический процесс на графике в координатах PV изображается семейством гипербол (см. рис. 1.7.1). Эти линии называются изотермами. Графики изотерм в других координатах также приведены на рис. 1.7.1.
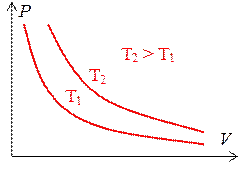
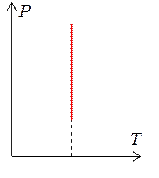

Рис. 1.7.1.
2. Изобарный процесс (P = const).
Изобарным процессом называется квазистатический процесс, протекающий при постоянном давлении P.
Из уравнения Клапейрона (1.7.1) следует, что для изобарного процесса отношение объема газа к его абсолютной температуре не изменяется (закон Гей-Люссака). Этот закон был открыт в 1802 году.
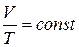 . (1.7.3)
. (1.7.3)
Линии, описывающие изобарный процесс называются изобарами. Графики изобар приведены на рис. 1.7.2.
Тангенс угла наклона изобары на графике в координатах VT равен  . Поэтому, если угол наклона прямой a1 > a2, то P 1 < P 2.
. Поэтому, если угол наклона прямой a1 > a2, то P 1 < P 2.
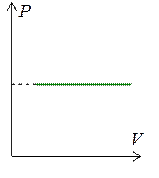

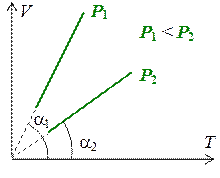
Рис. 1.7.2.
3. Изохорный процесс (V = const).
Изохорным процессом называется квазистатический процесс, протекающий при постоянном объёме V.
Из уравнения Клапейрона (1.7.1) следует, что для изохорного процесса отношение давления газа к его абсолютной температуре не изменяется (закон Шарля). Этот закон был открыт в 1787 году.
 . (1.7.3)
. (1.7.3)
Линии, описывающие изохорный процесс называются изохорами. Графики изохор приведены на рис. 1.7.3.
Тангенс угла наклона изохоры на графике в координатах PT равен  . Поэтому, если угол наклона прямой a1 > a2, то V 1 < V 2.
. Поэтому, если угол наклона прямой a1 > a2, то V 1 < V 2.

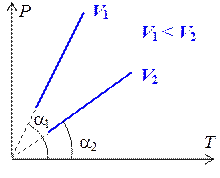
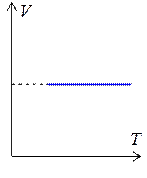
Рис. 1.7.3.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1910; Нарушение авторских прав?; Мы поможем в написании вашей работы!