
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фундаментальное уравнение Гиббса и вспомогательные термодинамические функции
|
|
|
|
Математический аппарат термодинамики строится на основе объединения уравнений первого и второго законов для обратимых процессов:
 ,
,
которые Гиббс назвал фундаментальным уравнением термодинамики.
Однако для практического применения неудобно использовать в
качестве независимой переменной энтропию S (которую непосредственно измерить нельзя). Чтобы избавиться от этого неудобства вводят вспомогательные термодинамические функции:
1) H=U + pV – энтальпия Н и ΔН удобны при анализе и оценке тепловых эффектов химических реакций,
2) F=U – TS – свободная энергия Гельмгольца, изохорно-изотермический потенциал,
3) G= U – TS +pV – свободная энергия Гиббса, изобарно-изотермический потенциал.
Соотношения между величинами термодинамических функций можно представить в виде схемы. Все функции имеют свою размерность.


Рис. 5.1. Важнейшие термодинамические функции:
а) их соотношение, б) зависимость от независимых перемен.
График справедлив для определенного состояния термодинамической системы. При изменении условий величины составляющих отрезков могут изменяться.
Использование функций Гельмгольца и Гиббса позволяет для изотермических процессов не рассматривать энтропию в числе контролируемых на опыте величин.
∆F и ∆G как критерии возможности самопроизвольного протекания процессов.
Изменение энергий ∆F и ∆G можно измерить по максимальной полезной работе при V,T = const и P,T = const.
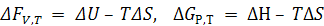 .
.
Для ∆GР,Т –∆Н – тепловой эффект химической реакции и ∆S – изменение энтропии реакции.
Таким образом, изменение ∆F и ∆G при определенных условиях является критерием возможности или невозможности протекания процесса.
Обобщив информацию по второму закону термодинамики, получим несколько критериев возможности направления протекания процесса.
Критерии возможности самопроизвольного протекания процесса
Таблица 5.1
| Функции | S | F | G |
| Определение | 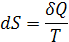
| F=U–TS | G=H–TS |
| Ограничения | изолированная система | T=const V=const | T=const Р=const |
| Критерий возможности самопроизвольного процесса | 
| 
| 
|
| Условия равновесия | максимум S dS=0 | минимум F dF=0 | минимум G dG=0 |
Для практического использования функций F и G полезно знать ответы на вопросы:
а) Различия между  T=const
T=const
1) 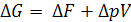 ,в конденсированных системах
,в конденсированных системах  , (5.14)
, (5.14)
2) в газовых системах, для которых применимо уравнение состояния идеального газа  а при
а при 
 . (5.15)
. (5.15)
б) Какие выводы надо делать, получив величины 
1) если  , без подведения дополнительной энергии извне процесс невозможен;
, без подведения дополнительной энергии извне процесс невозможен;
2) если  и термодинамика дает положительный ответ, это говорит только о возможности протекания прямого химического процесса.
и термодинамика дает положительный ответ, это говорит только о возможности протекания прямого химического процесса.
Однако часто в реальных условиях такой процесс не идет. Чтобы процесс пошел, нужно создать определенные условия для повышения скорости химической реакции.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1855; Нарушение авторских прав?; Мы поможем в написании вашей работы!