
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Строение мицелл коллоидных растворов
|
|
|
|
Лекция 21. Строение мицелл гидрофобных золей
Вопросы для самопроверки
1. Назовите основные методы получения коллоидных систем.
2. Поясните сущность дисперсионных и конденсационных методов получения коллоидных растворов, приведите примеры.
3. В чем заключается сущность электрохимических явлений? Рассмотрите явление электрофореза и электроосмоса.
4. Объясните, какова природа эффектов Дорна и Квинке. Как они возникают?
5. Назовите главную причину наличия электрокинетических явлений у дисперсных систем.
6. Изложите краткие сведения о современной теории строения двойного электрического слоя.
7. Дайте определение понятия “электрокинетический потенциал”.
8. Каким образом можно рассчитать значение ζ-потенциала и от каких факторов он зависит?
21.1 Строение мицелл коллоидных растворов.
21.2 Очистка коллоидных систем.
21.3 Агрегативная и седиментационная устойчивость дисперсных систем.
Советские и зарубежные ученые (А.В.Думанский, Н.Н.Песков, А.Н.Фрумкин, Веймарн, Паули и др.) на основе теории двойного электрического слоя создали так называемую мицеллярную теорию строения коллоидных частиц. Первоначально представления о мицеллярном строении частиц распространялись на все коллоидные растворы, в том числе и на лиофильные золи. Однако последующие исследования показали, что лиофильные золи (точнее растворы высокомолекулярных и высокополимерных соединений) имеют другое, отличное от лиофобных золей строение. В настоящее время мицеллярная теория строения коллоидных частиц сохраняет свое значение только для лиофобных (гидрофобных) золей.
Всякий лиофобный коллоидный раствор состоит из двух частей: мицелл и интермицеллярной жидкости. Мицеллы – это отдельные коллоидные частицы, которые в совокупности составляют дисперсную фазу золя, а интермицеллярная жидкость – это дисперсионная среда этого же золя, которая включает помимо среды-растворителя, все другие растворенные в ней вещества (электролиты и неэлектролиты), которые непосредственно не входят в состав мицелл.
Коллоидная мицелла имеет значительно более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю – нейтральную, обычно называемую ядром, и внешнюю – ионогенную, в свою очередь, состоящую из двух слоев (адсорбционного и диффузного). Адсорбционный слой слагается из слоя потенциалопределяющих ионов, адсорбированных на поверхности ядра и сообщающих ему свой заряд и части противоионов, проникших за плоскость скольжения и наиболее прочно связанных электростатическими силами притяжения. Вместе с ядром адсорбционный слой образует гигантских размеров многозарядный ион, называемый гранулой. Диффузный слой, расположенный за плоскостью скольжения, в отличие от адсорбционного не имеет в дисперсионной среде резко очертанной границы. Этот слой состоит из противоионов, общее число которых равняется в среднем разности между всем числом потенциалопределяющих ионов и числом противоионов, находящихся в абсорбционном слое.
Гранула вместе с диффузным слоем противоионов составляет коллоидную частицу – мицеллу. Мицелла всегда электронейтральна. Известно, что противоионами могут служить любые ионы тех электролитов, которые участвуют в реакциях при получении данного золя или присутствуют как посторонние примеси.
В качестве примера рассмотрим получение гидрозоля иодида серебра методом конденсации. Оно основано на химической реакции:
AgNO3 + KI → AgI + KNO3
Ядро коллоидной мицеллы в данном случае будет состоять из нейтральных молекул AgI. В зависимости от относительной концентрации реагирующих веществ может быть три случая.
1. Концентрация AgNO3 больше концентрации KI, нитрат серебра является стабилизатором золя.
nAgNO3 → nAg+ + nNO3−
Схема строения мицеллы золя иодида серебра имеет вид:
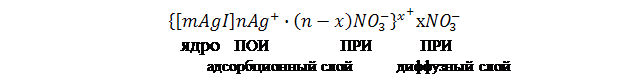
Коллоидная частица золя имеет положительный заряд (x+). Граница скольжения, по которой мицелла разрывается при движении в электрическом поле, лежит между коллоидной частицей и диффузным слоем.

Рис. 21.1 Схема строения мицеллы золя иодида серебра
2. Концентрация KI больше концентрации AgNO3, иодид калия является стабилизатором золя.
nKI → nK+ + nI−
Схема строения мицеллы золя иодида серебра:

Коллоидная частица золя имеет отрицательный заряд (x−).
3. Концентрации нитрата серебра и иодида калия равны. В этом случае золь находится в изоэлектрическом состоянии, т.е. в состоянии, при котором электрокинетический потенциал (дзета-потенциал) ζ = 0. В этом случае противоионы диффузного слоя мицеллы переходят в адсорбционный слой и коллоидная частица лишена заряда.
Например:
а) {[mAgI] nAg+ ∙ nNO3−}0
или
б) {[mAgI] nI− ∙ nK+}0
В коллоидной химии различают следующие виды пептизации:
а) адсорбционную;
б) диссолюционную;
в) промывание осадка растворителем.
Рассмотрим получение золей методом пептизации на примерах:
получение золей берлинской лазури адсорбционной пептизацией.
Приготовим осадок берлинской лазури KFe[Fe(CN)6]:
K4Fe(CN)6 + FeCI3 → KFe[Fe(CN)6] ↓ + 3KCI
свежий осадок
Добавим к образовавшемуся осадку электролит FeCI3 (пептизатор) – образуется золь, структурная единица дисперсионной фазы которого называется мицеллой.
Как происходит образование мицеллы? Ионы Fe3+ (потенциалопределяющие ионы) адсорбируются на поверхности частиц осадка m KFe[Fe(CN)6], заряжая их положительно, к положительно заряженной поверхности образовавшегося ядра мицеллы притягиваются ионы противоположного знака – противоионы (ионы CI− ). Часть этих ионов, составляющая адсорбционный слой, прочно удерживается у поверхности ядра за счет электростатических и адсорбционных сил. Ядро вместе с адсорбционным слоем составляет коллоидную частицу. Остальные противоионы связаны с ядром только электростатическими силами. Эти противоионы образуют диффузный слой. Наличие заряда у коллоидных частиц приводит к их отталкиванию и обеспечивает устойчивость золя.
Мицеллу золя берлинской лазури можно представить в виде круговой схемы:

Рис. 21.2 Схема строения мицеллы золя берлинской лазури.
Как следует из данных рисунка и приведенной выше структурной формулы мицеллы, на поверхности твердых частиц осадка располагаются противоположные по знаку заряда ионы, которые пространственно разделены. Эти ионы образуют двойной электрический слой.
Если для получения золя берлинской лазури берется некоторый избыток желтой кровяной соли, то стабилизатором золя будет K4[Fe(CN)6].
Процесс получения золя может быть представлен уравнением реакции:
3K4[Fe(CN)6] + 4FeCI3 → Fe4[Fe(CN)6] ↓ + 12KCI
избыток
Стабилизатор золя n K4[Fe(CN)6] → 4nK+ + [Fe(CN)6]4−
Мицеллы данного золя выражаются формулой:
{[Fe4[Fe(CN)6 ]3] n[Fe(CN)6 ]4− ∙ 4(n−x)K+ }4x− 4xK+ ,
а коллоидные частицы имеют отрицательный заряд (ПОИ [Fe(CN)6 ]4− ).
Диссолюционная пептизация отличается от адсорбционной только отсутствием в готовом виде электролита-пептизатора. Рассмотрим на примере получения золя гидроксида железа.
{[mFe(ОН)3 ]∙nFeO+ ∙ (n−x)CI}x+ ∙xCI− .
Метод промывания осадка растворителем используется, если осадок получен при значительном избытке одного из реагентов. Это вызывает сжатие двойного электрического слоя. Ионы диффузного слоя проникают в адсорбционный и в результате заряд коллоидной частицы становится равным нулю:
{[mFe(ОН)3 ]∙nFe3+ ∙3nCI−}0 .
После промывания осадка растворителем мицеллы будут иметь вид:
{[mFe(ОН)3 ]∙nFe3+ ∙3(n−x)CI−}3х+3х CI−.
Химический метод конденсации основан на реакциях, приводящих к возникновению твердого продукта. Это реакции:
а) восстановления. Например, получение золей золота и серебра при взаимодействии солей этих металлов с восстановителями:
2KAuO2 + 3HCHO + K2CO3 → 2Au + 3HCOOK + KHCO3 + H2O.
{[mAu]∙nAuO2 − ∙(n−x)K+ }x− ∙xK+ − мицелла золя золота.
б) окисления. Например, получение золя серы:
H2 S +½O2 → S + H2O
Параллельно протекают более сложные процессы, приводящие к образованию политионовых кислот H2S5O6, являющихся стабилизаторами. Строение мицеллы полученного золя можно представить следующей формулой:
{[mS]∙nS5O62−∙2(n−x)H+}2x−∙2xH+
в) гидролиза. Например, красно-бурый золь гидроксида железа получается, если в кипящую воду добавить небольшое количество хлорида железа:
FeCI3 + 3H2O → Fe(OH)3 + 3HCI
Потенциалопределяющие ионы: Fe3+,FeO+,H+.Таким образом, мицелла золя
Fe(OH)3 в соответствии с тем, какой ион является стабилизатором, может быть выражена формулами:
{[mFe(ОН)3 ]∙nFeO+ ∙(n−x)CI}x+ ∙ xCI− ,
{[mFe(ОН)3 ]∙nFe3+ ∙3(n−x)CI− }3x+ ∙ 3xCI−
{[mFe(ОН)3 ]∙nH+∙(n−x)CI}x+ ∙ xCI–.
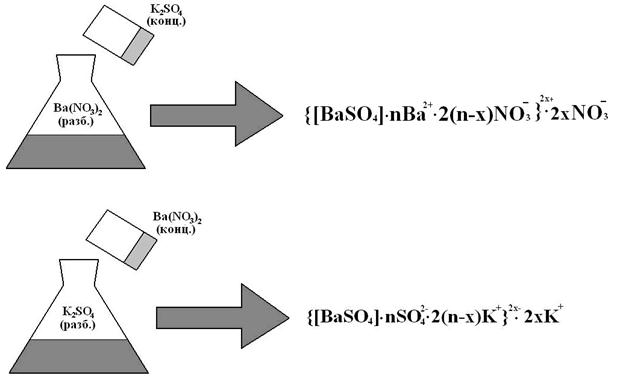
г) обмена. Например, получение золя сульфата бария.
При использовании реакции обмена состав мицелл зависит от того, что к чему приливать!
Примером получения коллоидных систем кристаллизацией является кристаллизация из пересыщенного раствора сахарозы в производстве сахара. Процесс десублимации имеет место при образовании облаков, когда в условиях переохлажденного состояния из водяных паров образуется сразу кристаллики, а не капли воды.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 44489; Нарушение авторских прав?; Мы поможем в написании вашей работы!